题目内容
X元素位于第ⅡA族,核内有12个中子,它在最高价的氧化物中的质量分数是60%.Y元素的原子核外有16个电子.X与Y所形成的化合物的化学式为 ,它是通过 键结合的.用电子式表明其形成过程 .
考点:原子结构与元素的性质,用电子式表示简单的离子化合物和共价化合物的形成
专题:原子组成与结构专题
分析:X元素位于第ⅡA族,在化合物中显+2价,其最高价氧化物化学式为XO,其最高价氧化物中X质量分数为60%,则O元素质量分数为40%,设其相对分子质量为a,则a:16=60%:40%,所以a=24,其质量数为24,则X原子核内质子数=24-12=12,为Mg元素;
原子中核外电子数=核内质子数=原子序数,Y元素的原子核外有16个电子,则Y原子序数为16,为S元素;
X、Y通过得失电子形成离子化合物MgS.
原子中核外电子数=核内质子数=原子序数,Y元素的原子核外有16个电子,则Y原子序数为16,为S元素;
X、Y通过得失电子形成离子化合物MgS.
解答:
解:X元素位于第ⅡA族,在化合物中显+2价,其最高价氧化物化学式为XO,其最高价氧化物中X质量分数为60%,则O元素质量分数为40%,设其相对分子质量为a,则a:16=60%:40%,所以a=24,其质量数为24,则X原子核内质子数=24-12=12,为Mg元素;
原子中核外电子数=核内质子数=原子序数,Y元素的原子核外有16个电子,则Y原子序数为16,为S元素;
Mg和S通过得失电子形成离子化合物MgS,MgS中只存在离子键,其形成过程为: ,
,
故答案为:MgS;离子; .
.
原子中核外电子数=核内质子数=原子序数,Y元素的原子核外有16个电子,则Y原子序数为16,为S元素;
Mg和S通过得失电子形成离子化合物MgS,MgS中只存在离子键,其形成过程为:
 ,
,故答案为:MgS;离子;
 .
.
点评:本题考查了原子结构和元素性质,涉及离子化合物电子式的书写、元素推断等知识点,正确推断元素是解本题关键,知道共价化合物和离子化合物电子式书写区别,题目难度不大.

练习册系列答案
相关题目
如图所示,a、b、c、d、e为周期表前4周期的一部分元素,下列叙述正确的是( )
| a | ||||
| b | ||||
| c | d | |||
| e |
| A、b元素除0价外,只有一种化合价 |
| B、五种元素中,c元素的性质最稳定 |
| C、b、d气态氢化物溶于水,溶液的酸性:b>d |
| D、e元素最高价氧化物的水化物和不同量的氢氧化钠溶液反应,可能生成三种盐 |

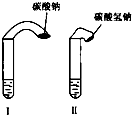 (1)高中教材中有这样一个实验:在两支试管中分别加入3mL稀盐酸(均足量)(只有浓度小于1mol?L-1的稀盐酸跟Na2CO3和NaHCO3反应才能根据反应的剧烈程度区分开来,浓度较高则反应现象都是同样的剧烈),将两个各装有0.3g NaHCO3和Na2CO3粉末的小气球分别套在两支试管口上.将气球内的NaHCO3和Na2CO3同时倒入试管中,观察到现象如下:
(1)高中教材中有这样一个实验:在两支试管中分别加入3mL稀盐酸(均足量)(只有浓度小于1mol?L-1的稀盐酸跟Na2CO3和NaHCO3反应才能根据反应的剧烈程度区分开来,浓度较高则反应现象都是同样的剧烈),将两个各装有0.3g NaHCO3和Na2CO3粉末的小气球分别套在两支试管口上.将气球内的NaHCO3和Na2CO3同时倒入试管中,观察到现象如下: