题目内容
2molO3和3molO2的质量之比为 ,分子数之比为 ,氧原子数之比为 ;平均摩尔质量为 ;同温同压下,体积之比为 .
考点:物质的量的相关计算
专题:计算题
分析:根据m=nM、N=nNA、M=
、V=nVm结合分子构成进行计算.
| m |
| n |
解答:
解:根据m=nM知,二者的质量之比=(2mol×48g/mol):(3mol×32g/mol)=1:1;
根据N=nNA知,二者的物质的量之比等于去分子数之比,所以其分子数之比为2:3;
其氧原子个数之比=(2mol×3):(3mol×2)=1:1;
其平均摩尔质量M=
=
=38.4g/mol,
根据V=nVm知,相同条件下,两种气体的体积之比等于其物质的量之比=2mol:3mol=2:3,
故答案为:1:1;2:3;1:1;38.4g/mol;2:3.
根据N=nNA知,二者的物质的量之比等于去分子数之比,所以其分子数之比为2:3;
其氧原子个数之比=(2mol×3):(3mol×2)=1:1;
其平均摩尔质量M=
| m |
| n |
| 48g/mol×2mol+32g/mol×3mol |
| 2mol+3mol |
根据V=nVm知,相同条件下,两种气体的体积之比等于其物质的量之比=2mol:3mol=2:3,
故答案为:1:1;2:3;1:1;38.4g/mol;2:3.
点评:本题考查了物质的量的有关计算,熟悉物质的量的有关公式即可解答,计算气体体积时要注意温度和压强是否相等,为易错点.

练习册系列答案
相关题目
将相同物质的量浓度的某弱酸HX溶液与NaX溶液等体积混合,测得混合后溶液中c(Na+)<c(X-),则下列关系正确的是( )
| A、c(OH-)<c(H+) |
| B、c(HX )>c(X-) |
| C、c(X-)+c(HX )=2c(Na+) |
| D、c(Na+)+c(OH-)=c(H+)-c(HX) |
X、Y、Z、W为四种短周期主族元素,其中X、Z同族,Y、Z同周期,W是短周期主族元素中原子半径最大的,X原子最外层电子数是核外电子层数的3倍,Y的最高正价与最低负价代数和为6.下列说法正确的是( )
| A、Y元素最高价氧化物对应的水化物化学式H2YO4 |
| B、原子半径由大到小的顺序为:Z>Y>W |
| C、W、Z两种元素的气态氢化物中,Z的气态氢化物较稳定 |
| D、X与W形成的两种化合物中,阴、阳离子物质的量之比均为1:2 |
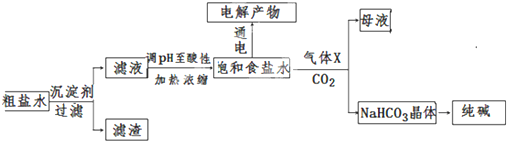
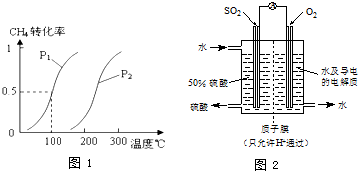

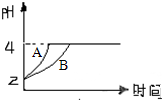 (1)常温下,某纯碱(Na2CO3)溶液中滴入酚酞,溶液呈红色.则该溶液呈
(1)常温下,某纯碱(Na2CO3)溶液中滴入酚酞,溶液呈红色.则该溶液呈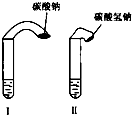 (1)高中教材中有这样一个实验:在两支试管中分别加入3mL稀盐酸(均足量)(只有浓度小于1mol?L-1的稀盐酸跟Na2CO3和NaHCO3反应才能根据反应的剧烈程度区分开来,浓度较高则反应现象都是同样的剧烈),将两个各装有0.3g NaHCO3和Na2CO3粉末的小气球分别套在两支试管口上.将气球内的NaHCO3和Na2CO3同时倒入试管中,观察到现象如下:
(1)高中教材中有这样一个实验:在两支试管中分别加入3mL稀盐酸(均足量)(只有浓度小于1mol?L-1的稀盐酸跟Na2CO3和NaHCO3反应才能根据反应的剧烈程度区分开来,浓度较高则反应现象都是同样的剧烈),将两个各装有0.3g NaHCO3和Na2CO3粉末的小气球分别套在两支试管口上.将气球内的NaHCO3和Na2CO3同时倒入试管中,观察到现象如下: