题目内容
17. 工业上用CO和H2生产燃料甲醇.一定条件下密闭容器中发生反应,测得数据曲线如图所示(反应混合物均呈气态).下列说法错误的是( )
工业上用CO和H2生产燃料甲醇.一定条件下密闭容器中发生反应,测得数据曲线如图所示(反应混合物均呈气态).下列说法错误的是( )| A. | 反应的化学方程式:CO+2H2?CH3OH | |
| B. | 反应进行至3分钟时,正、逆反应速率相等 | |
| C. | 反应至10分钟,?(CO)=0.075 mol/L•min | |
| D. | 增大压强,平衡正向移动,K不变 |
分析 由图可知,CO的浓度减小,甲醇浓度增大,且平衡时c(CO)=0.25mol/L,c(CH3OH)=0.75mol/L,转化的c(CO)=0.75mol/L,结合质量守恒定律可知反应为CO+2H2?CH3OH,3min时浓度仍在变化,浓度不变时为平衡状态,且增大压强平衡向体积减小的方向移动,以此来解答.
解答 解:A.用CO和H2生产燃料甲醇,反应为CO+2H2?CH3OH,故A正确;
B.反应进行至3分钟时浓度仍在变化,没有达到平衡状态,则正、逆反应速率不相等,故B错误;
C.反应至10分钟,?(CO)=$\frac{0.75mol/L}{10min}$=0.075 mol/L•min,故C正确;
D.该反应为气体体积减小的反应,且K与温度有关,则增大压强,平衡正向移动,K不变,故D正确;
故选B.
点评 本题考查物质的量浓度与时间的变化曲线,为高频考点,把握图中浓度的变化、平衡判断、压强对平衡的影响为解答的关键,侧重分析与应用能力的考查,注意选项B为易错点,题目难度不大.

练习册系列答案
 学练快车道快乐假期暑假作业新疆人民出版社系列答案
学练快车道快乐假期暑假作业新疆人民出版社系列答案 浙大优学小学年级衔接导与练浙江大学出版社系列答案
浙大优学小学年级衔接导与练浙江大学出版社系列答案 小学暑假作业东南大学出版社系列答案
小学暑假作业东南大学出版社系列答案
相关题目
7.用惰性电极分别电解下列各物质的水溶液一段时间后,向剩余溶液中加入适量水能使溶液恢复到电解前浓度的是( )
| A. | Cu(NO3)2 | B. | HCl | C. | MgCl2 | D. | Na2SO4 |
8.适量下列物质中,不能使湿润的淀粉碘化钾试纸变蓝的是( )
| A. | 氯气 | B. | 碘水 | C. | 氯化钠溶液 | D. | 溴水 |
5.已知常温下浓度为0.1mol•L-1的下列溶液的pH如表所示:下列有关说法正确的是( )
| 溶质 | NaF | NaClO | Na2CO3 |
| pH | 7.5 | 9.7 | 11.6 |
| A. | 根据上表得出三种酸电离平衡常数的大小关系为:HF>HClO>H2CO3(一级电离平衡常数) | |
| B. | 加热0.1mol•L-1NaClO溶液其pH,PH小于9.7 | |
| C. | pH=2的HF溶液与pH=12的NaOH溶液以等体积混合,则有c(Na+)═c(F-)>c(H+)=c(OH-) | |
| D. | 0.1 mol•L-1Na2CO3溶液中,存在的关系:c(OH-)-c(H+)═c(HCO3-)+2c(H2CO3) |
12.为实现相关实验目的,选用的试剂、装置和操作均合理的是( )
| 实验目的 | 实验内容 | |
| A | 证明氨水中存在一水合氨的电离平衡 | 向含有酚酞的氨水中加入少量NaOH固体 |
| B | 配制100mL1.0mol•L-1 NaOH 溶液 | 向100mL容量瓶中加入4.0g NaOH固体,加水到刻度线 |
| C | 模拟利用牺牲阳极的阴极保护法保护铁 | 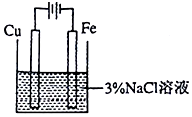 |
| D | 比较Cl-和I-的还原性 | 将少量Cl2通入滴有淀粉溶液的KI溶液中 |
| A. | A | B. | B | C. | C | D. | D |
2.下列说法正确的是( )
| A. | 铅蓄电池反应为Pb+PbO2+2H2SO4$?_{充电}^{放电}$2PbSO4+2H2O,放电时负极质量减轻 | |
| B. | 电解精炼铜时,以粗铜作阴极,纯铜作阳极 | |
| C. | CH3COONa稀溶液加水稀释后,溶液中$\frac{c(C{H}_{3}COOH)}{c(C{H}_{3}CO{O}^{-})}$ 的值增大 | |
| D. | CaCO3(s)=CaO(s)+CO2(g)室温下不能自发进行,说明该反应的△H<0 |
9.有X、Y、Z、W是4种原子序数依次增大的短周期元素,其中X原子在元素周期表中原子半径最小,Y、Z位于同一主族,Y原子的最外层电子数是其电子层数的3倍.下列说法正确的是( )
| A. | 元素非金属性:Z<X<Y | |
| B. | 原子半径:W>Z>Y | |
| C. | 0.1mol/L溶液pH:X2Z<XW | |
| D. | Z2W2中各原子都达到稳定结构,其电子式是  |
7.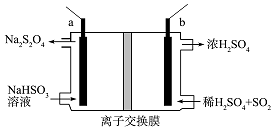 连二亚硫酸钠(Na2S2O4)俗称保险粉,是一种强还原剂.工业常用惰性电极电解亚硫酸氢钠的方法制备连二亚硫酸钠,原理装置如图所示,下列说法正确的是( )
连二亚硫酸钠(Na2S2O4)俗称保险粉,是一种强还原剂.工业常用惰性电极电解亚硫酸氢钠的方法制备连二亚硫酸钠,原理装置如图所示,下列说法正确的是( )
 连二亚硫酸钠(Na2S2O4)俗称保险粉,是一种强还原剂.工业常用惰性电极电解亚硫酸氢钠的方法制备连二亚硫酸钠,原理装置如图所示,下列说法正确的是( )
连二亚硫酸钠(Na2S2O4)俗称保险粉,是一种强还原剂.工业常用惰性电极电解亚硫酸氢钠的方法制备连二亚硫酸钠,原理装置如图所示,下列说法正确的是( )| A. | b电极应该接电源的负极 | |
| B. | 装置中所用离子交换膜为阴离子交换膜 | |
| C. | 电路中每转移1mole-消耗SO2的体积为11.2L | |
| D. | a电极的电极反应式为:2HSO3-+2e-+2H+═S2O42-+2H2O |
7.已知25℃时,CH3COOH和HCN的电离平衡常数分别为1.75×10-5、4.9×10-10,下列有关叙述正确的是( )
| A. | 中和等体积、等pH的CH3COOH溶液和HCN溶液消耗NaOH的量前者小于后者 | |
| B. | 常温下,等浓度CH3COONa溶液的pH大于NaCN溶液的pH | |
| C. | 常温下,等体积、等浓度CH3COONa溶液的离子总数等于NaCN溶液的离子总数 | |
| D. | 反应CH3COOH+CN-?HCN+CH3COO-的化学平衡常数为2.8×10-5 |