题目内容
5.已知常温下浓度为0.1mol•L-1的下列溶液的pH如表所示:下列有关说法正确的是( )| 溶质 | NaF | NaClO | Na2CO3 |
| pH | 7.5 | 9.7 | 11.6 |
| A. | 根据上表得出三种酸电离平衡常数的大小关系为:HF>HClO>H2CO3(一级电离平衡常数) | |
| B. | 加热0.1mol•L-1NaClO溶液其pH,PH小于9.7 | |
| C. | pH=2的HF溶液与pH=12的NaOH溶液以等体积混合,则有c(Na+)═c(F-)>c(H+)=c(OH-) | |
| D. | 0.1 mol•L-1Na2CO3溶液中,存在的关系:c(OH-)-c(H+)═c(HCO3-)+2c(H2CO3) |
分析 A.相同温度下,相同浓度的钠盐溶液中,弱酸根离子水解程度越大其溶液pH越大,酸根离子水解程度越大其相对应的酸的电离程度越小,即酸的电离平衡常数越小;B.盐类水解是吸热反应,升高温度促进盐类水解;
C.常温下NaF溶液pH=7.5>7,NaF溶液呈碱性,说明NaF是强碱弱酸盐,则HF是弱酸;pH=2的HF浓度大于pH=12的NaOH溶液浓度,二者等体积混合HF有剩余,溶液呈酸性;
D.根据物料守恒:2[c(CO32-)+c(HCO3-)+c(H2CO3)]=c(Na+),根据电荷守恒得c(H+)+c(Na+)=c(OH-)+c(HCO3-)+2c(CO32-);
解答 解:A.相同温度下,相同浓度的钠盐溶液中,弱酸根离子水解程度越大其溶液pH越大,酸根离子水解程度越大其相对应的酸的电离程度越小,即酸的电离平衡常数越小,根据表中数据知,酸根离子水解程度F-<ClO-<CO32-,则酸的电离平衡常数HF>HClO>HCO3-,故A错误;
B.盐类水解是吸热反应,升高温度促进盐类水解NaClO溶液pH>7,则NaClO是强碱弱酸盐,升高温度促进其水解,溶液的碱性增强,pH增大,故B错误;
C.常温下NaF溶液pH=7.5>7,NaF溶液呈碱性,说明NaF是强碱弱酸盐,则HF是弱酸;pH=2的HF浓度大于pH=12的NaOH溶液浓度,二者等体积混合HF有剩余,溶液呈酸性,则c(H+)>c(OH-),结合电荷守恒得c(Na+)<c(F-),酸的电离程度较小,则溶液中离子浓度大小顺序是c(F-)>c(Na+)>c(H+)>c(OH-),故C错误;
D.根据物料守恒:2[c(CO32-)+c(HCO3-)+c(H2CO3)]=c(Na+),根据电荷守恒得c(H+)+c(Na+)=c(OH-)+c(HCO3-)+2c(CO32-),所以得c(OH-)-c(H+)=c(HCO3-)+2c(H2CO3),故D正确;
故选D.
点评 本题考查离子浓度大小比较,为高频考点,侧重考查学生分析推断能力,明确酸的电离程度与酸根离子水解程度关系、溶液中溶质成分及其性质是解本题关键,易错选项是D,注意碳酸根离子对应的酸是碳酸氢根离子而不是碳酸,题目难度中等.

| A. | 向2mL10%的NaOH溶液中滴加2%CuSO4溶液4~6滴制得新制氢氧化铜悬浊液 | |
| B. | 将Al2(SO4)3溶液蒸干、灼烧至恒重,最终剩余固体是Al2O3 | |
| C. | 将水蒸气通过灼热的铁粉,铁粉变红棕色,说明铁与水在高温下能发生反应 | |
| D. | 取a克Na2CO3和NaHCO3混合物与少量稀盐酸充分反应,加热、蒸干、灼烧至熔化,冷却得b克固体,可测得Na2CO3质量分数 |

| A. | 苯环上的一溴代物有6种 | B. | 该分子中的所有碳原子可能共平面 | ||
| C. | 该有机物的分子式为C16H17O5 | D. | l mol该有机物可消耗3molNaOH |
| A. | 推广使用清洁能源 | B. | 大力发展燃煤发电 | ||
| C. | 循环高效利用费源 | D. | 倡导环保低碳生活 |
| A. | “甘之如饴”说明糖类均有甜味 | |
| B. | “熬胆矾铁釜,久之亦化为铜”,该过程发生了置换反应 | |
| C. | “霾尘积聚难见路人”,雾霾所形成的气溶胶具有丁达尔效应 | |
| D. | 古剑“以剂钢为刃,柔铁为茎干,不尔则多断折”,剂钢指的是铁的合金 |
| W | 某种氧化物是淡黄色固体 |
| X | 短周期中最高价氧化物对应水化物酸性最强 |
| Y | 第三周期中离子半径最小的 |
| Z | 原子最外层电子数是电子总数的$\frac{2}{3}$ |
| A. | W、Y、X的原子半径依次减小,Y、W、X简单离子的半径依次增大 | |
| B. | W、X、Y的最高价氧化物的水化物之间可以两两反应 | |
| C. | W的氧化物与Z的最高价氧化物反应一定是氧化还原反应 | |
| D. | 金属性W比Y强,非金属性Z比X弱 |
 工业上用CO和H2生产燃料甲醇.一定条件下密闭容器中发生反应,测得数据曲线如图所示(反应混合物均呈气态).下列说法错误的是( )
工业上用CO和H2生产燃料甲醇.一定条件下密闭容器中发生反应,测得数据曲线如图所示(反应混合物均呈气态).下列说法错误的是( )| A. | 反应的化学方程式:CO+2H2?CH3OH | |
| B. | 反应进行至3分钟时,正、逆反应速率相等 | |
| C. | 反应至10分钟,?(CO)=0.075 mol/L•min | |
| D. | 增大压强,平衡正向移动,K不变 |
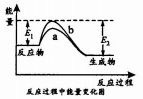
| A. | △H=+|E1-E2| | |
| B. | 曲线a为催化剂时的反应 | |
| C. | X(g)的能量高于Z(g)的能量 | |
| D. | 反应物吸收的总能量大于生成物释放的总能量 |
| A. | 泡利 | B. | 洪特 | C. | J•K罗林 | D. | 鲍林 |