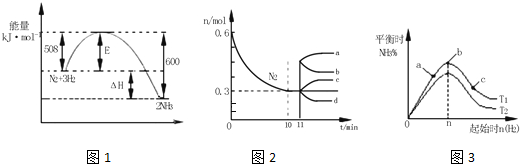
题目内容
7.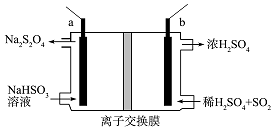 连二亚硫酸钠(Na2S2O4)俗称保险粉,是一种强还原剂.工业常用惰性电极电解亚硫酸氢钠的方法制备连二亚硫酸钠,原理装置如图所示,下列说法正确的是( )
连二亚硫酸钠(Na2S2O4)俗称保险粉,是一种强还原剂.工业常用惰性电极电解亚硫酸氢钠的方法制备连二亚硫酸钠,原理装置如图所示,下列说法正确的是( )| A. | b电极应该接电源的负极 | |
| B. | 装置中所用离子交换膜为阴离子交换膜 | |
| C. | 电路中每转移1mole-消耗SO2的体积为11.2L | |
| D. | a电极的电极反应式为:2HSO3-+2e-+2H+═S2O42-+2H2O |
分析 a极上NaHSO3生成Na2S2O4,S元素化合价由+4价降低到+3价,发生还原反应,应为阴极,a连接电源的负极,b极上二氧化硫被氧化生成硫酸,为阳极,b连接电源的正极,以此解答该题.
解答 解:A.b极上二氧化硫被氧化生成硫酸,为阳极,b连接电源的正极,故A错误;
B.b极生成硫酸,氢离子浓度增大,而阳极反应为2HSO3-+2e-+2H+═S2O42-+2H2O,阳极消耗氢离子,则装置中所用离子交换膜为阳离子交换膜,故B错误;
C.气体存在的条件未知,不能确定体积大小,故C错误;
D.a极上NaHSO3生成Na2S2O4,发生氧化反应,电极方程式为2HSO3-+2e-+2H+═S2O42-+2H2O,故D正确.
故选D.
点评 本题考查电解池原理,为高频考点,侧重于学生的分析能力的考查,注意把握电解池的工作原理,难点的电极反应式的书写,题目难度中等.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
16.某有机物结构简式如图,下列关于该有机物的说法正确的是( )


| A. | 苯环上的一溴代物有6种 | B. | 该分子中的所有碳原子可能共平面 | ||
| C. | 该有机物的分子式为C16H17O5 | D. | l mol该有机物可消耗3molNaOH |
17. 工业上用CO和H2生产燃料甲醇.一定条件下密闭容器中发生反应,测得数据曲线如图所示(反应混合物均呈气态).下列说法错误的是( )
工业上用CO和H2生产燃料甲醇.一定条件下密闭容器中发生反应,测得数据曲线如图所示(反应混合物均呈气态).下列说法错误的是( )
 工业上用CO和H2生产燃料甲醇.一定条件下密闭容器中发生反应,测得数据曲线如图所示(反应混合物均呈气态).下列说法错误的是( )
工业上用CO和H2生产燃料甲醇.一定条件下密闭容器中发生反应,测得数据曲线如图所示(反应混合物均呈气态).下列说法错误的是( )| A. | 反应的化学方程式:CO+2H2?CH3OH | |
| B. | 反应进行至3分钟时,正、逆反应速率相等 | |
| C. | 反应至10分钟,?(CO)=0.075 mol/L•min | |
| D. | 增大压强,平衡正向移动,K不变 |
14.已知反应2X(g)+Y(g)?2Z(g)△H的能量变化如图所示,下列分析正确的是( )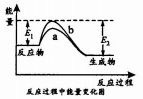

| A. | △H=+|E1-E2| | |
| B. | 曲线a为催化剂时的反应 | |
| C. | X(g)的能量高于Z(g)的能量 | |
| D. | 反应物吸收的总能量大于生成物释放的总能量 |
12.下列反应中,氧元素被还原的是( )
| A. | 2Na+O2$\frac{\underline{\;点燃\;}}{\;}$Na2O2 | B. | Na2O+H2O═2NaOH | ||
| C. | 2F2+2H2O═4HF+O2 | D. | 2C+SiO2$\frac{\underline{\;高温\;}}{\;}$2CO↑+Si |
16.提出杂化轨道理论的科学家是( )
| A. | 泡利 | B. | 洪特 | C. | J•K罗林 | D. | 鲍林 |
15.X、Y、Z、R是短周期主族元素,X元素是形成有机化合物的必需元素,Y元素的原子最外层电子数是次外层的三倍,Z元素的原子半径是短周期元素中最大的,R原子的核外电子数是X原子核Z原子的核外电子数之和.下列叙述不正确的是( )
| A. | XY2是形成酸雨的主要污染物 | |
| B. | X、Y、R三种元素的非金属性Y>R>X | |
| C. | X、Z分别与R形成的化合物中化学键类型不同 | |
| D. | 含有Y、Z、R三种元素的化合物溶液可能显碱性 |