题目内容
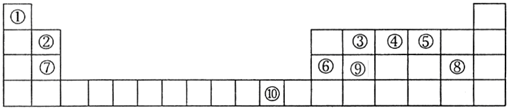
下列是元素周期表的一部分,表中所列字母分别代表某一化学元素.
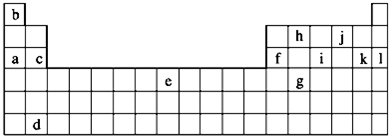
(1)表中代表金属元素的字母有 (填字母表示).
(2)表中字母表示的单质中常温常压下属于气体的有 (填分子式).
(3)写出h与k元素组成的分子的电子式: ,该分子含有 (填“极性”或“非极性”)键.
(4)试画出g元素的原子结构示意图: .
(5)将表中短周期字母元素挑出四种,另用W、X、Y、Z表示,其原子序数X>W>Z>Y,X原子最外层电子数与最内层电子数相等,Y原子最外层电子数是内层电子数的2倍,W原子和Z原子可形成2:1和1:1两种化合物,Z原子最外层电子数是核外电子层数的3倍.
①X元素单质能与Z、Y形成的稳定化合物反应,该化学反应方程式为 .
②W、X元素的最高价氧化物对应水化物的碱性强弱为: < (用化学式表示).
③这四种元素原子半径的大小为 > > > (填元素符号).

(1)表中代表金属元素的字母有
(2)表中字母表示的单质中常温常压下属于气体的有
(3)写出h与k元素组成的分子的电子式:
(4)试画出g元素的原子结构示意图:
(5)将表中短周期字母元素挑出四种,另用W、X、Y、Z表示,其原子序数X>W>Z>Y,X原子最外层电子数与最内层电子数相等,Y原子最外层电子数是内层电子数的2倍,W原子和Z原子可形成2:1和1:1两种化合物,Z原子最外层电子数是核外电子层数的3倍.
①X元素单质能与Z、Y形成的稳定化合物反应,该化学反应方程式为
②W、X元素的最高价氧化物对应水化物的碱性强弱为:
③这四种元素原子半径的大小为
考点:元素周期律和元素周期表的综合应用
专题:元素周期律与元素周期表专题
分析:由元素在周期表中位置,可知a为Na、b为H、c为Mg、d为Ba、e为Fe、f为Al、g为Ge、h为C、i为P、j为O、k为Cl、l为Ar.
(1)上述元素中Na、Mg、Ba、Fe、Al、Ge属于金属元素;
(2)上述元素单质中常温常压下属于气体的有:氢气、氧气、氯气、氩;
(3)h与k元素组成的分子为CCl4,分子中C原子与Cl原子之间形成1对共用电子对,C、Cl原子对共用电子对吸引不同,属于极性键;
(4)Ge的原子序数为6+8+18=32,原子核外电子数为32,有4个电子层,构成电子数为2、8、18、4;
(5)W、X、Y、Z为表中元素,且属于短周期元素,原子序数X>W>Z>Y,Y原子最外层电子数是内层电子数的2倍,Y原子只能有2个电子层,最外层电子数为4,故Y为碳元素,X原子最外层电子数与最内层电子数相等,则X为Mg,Z原子最外层电子数是核外电子层数的3倍,结合原子序数可知Z只能处于第二周期,可推知Z为O元素,W原子和Z原子可形成2:1和1:1两种化合物,则W为Na,
①X为Mg,Z、Y形成的稳定化合物为CO2,二者反应生成MgO与碳;
②金属性越强,最高价氧化物对应水化物的碱性越强;
③同周期自左而右原子半径减小,同主族自上而下原子半径增大.
(1)上述元素中Na、Mg、Ba、Fe、Al、Ge属于金属元素;
(2)上述元素单质中常温常压下属于气体的有:氢气、氧气、氯气、氩;
(3)h与k元素组成的分子为CCl4,分子中C原子与Cl原子之间形成1对共用电子对,C、Cl原子对共用电子对吸引不同,属于极性键;
(4)Ge的原子序数为6+8+18=32,原子核外电子数为32,有4个电子层,构成电子数为2、8、18、4;
(5)W、X、Y、Z为表中元素,且属于短周期元素,原子序数X>W>Z>Y,Y原子最外层电子数是内层电子数的2倍,Y原子只能有2个电子层,最外层电子数为4,故Y为碳元素,X原子最外层电子数与最内层电子数相等,则X为Mg,Z原子最外层电子数是核外电子层数的3倍,结合原子序数可知Z只能处于第二周期,可推知Z为O元素,W原子和Z原子可形成2:1和1:1两种化合物,则W为Na,
①X为Mg,Z、Y形成的稳定化合物为CO2,二者反应生成MgO与碳;
②金属性越强,最高价氧化物对应水化物的碱性越强;
③同周期自左而右原子半径减小,同主族自上而下原子半径增大.
解答:
解:由元素在周期表中位置,可知a为Na、b为H、c为Mg、d为Ba、e为Fe、f为Al、g为Ge、h为C、i为P、j为O、k为Cl、l为Ar.
(1)上述元素中Na、Mg、Ba、Fe、Al、Ge属于金属元素,对应的字母编号为:a、c、d、e、f、g,故答案为:a、c、d、e、f、g;
(2)上述元素单质中常温常压下属于气体的有:氢气、氧气、氯气、氩,对应的分子式为:H2、O2、Cl2、Ar,故答案为:H2、O2、Cl2、Ar;
(3)h与k元素组成的分子为CCl4,分子中C原子与Cl原子之间形成1对共用电子对,其电子式为: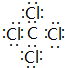 ,C、Cl原子对共用电子对吸引不同,属于极性键,故答案为:
,C、Cl原子对共用电子对吸引不同,属于极性键,故答案为: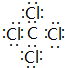 ;极性;
;极性;
(4)Ge的原子序数为6+8+18=32,原子核外电子数为32,有4个电子层,构成电子数为2、8、18、4,其原子结构示意图为: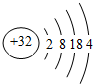 ,故答案为:
,故答案为: ;
;
(5)W、X、Y、Z为表中元素,且属于短周期元素,原子序数X>W>Z>Y,Y原子最外层电子数是内层电子数的2倍,Y原子只能有2个电子层,最外层电子数为4,故Y为碳元素,X原子最外层电子数与最内层电子数相等,则X为Mg,Z原子最外层电子数是核外电子层数的3倍,结合原子序数可知Z只能处于第二周期,可推知Z为O元素,W原子和Z原子可形成2:1和1:1两种化合物,则W为Na,
①X为Mg,Z、Y形成的稳定化合物为CO2,二者反应生成MgO与碳,反应方程式为:2Mg+CO2
2MgO+C,故答案为:2Mg+CO2
2MgO+C;
②金属性Mg<Na,金属性越强,最高价氧化物对应水化物的碱性越强,故碱性:Mg(OH)2<NaOH,故答案为:Mg(OH)2<NaOH;
③同周期自左而右原子半径减小,同主族自上而下原子半径增大,故原子半径:Na>Mg>C>O,故答案为:Na>Mg>C>O.
(1)上述元素中Na、Mg、Ba、Fe、Al、Ge属于金属元素,对应的字母编号为:a、c、d、e、f、g,故答案为:a、c、d、e、f、g;
(2)上述元素单质中常温常压下属于气体的有:氢气、氧气、氯气、氩,对应的分子式为:H2、O2、Cl2、Ar,故答案为:H2、O2、Cl2、Ar;
(3)h与k元素组成的分子为CCl4,分子中C原子与Cl原子之间形成1对共用电子对,其电子式为:
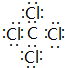 ,C、Cl原子对共用电子对吸引不同,属于极性键,故答案为:
,C、Cl原子对共用电子对吸引不同,属于极性键,故答案为: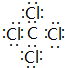 ;极性;
;极性;(4)Ge的原子序数为6+8+18=32,原子核外电子数为32,有4个电子层,构成电子数为2、8、18、4,其原子结构示意图为:
 ,故答案为:
,故答案为: ;
;(5)W、X、Y、Z为表中元素,且属于短周期元素,原子序数X>W>Z>Y,Y原子最外层电子数是内层电子数的2倍,Y原子只能有2个电子层,最外层电子数为4,故Y为碳元素,X原子最外层电子数与最内层电子数相等,则X为Mg,Z原子最外层电子数是核外电子层数的3倍,结合原子序数可知Z只能处于第二周期,可推知Z为O元素,W原子和Z原子可形成2:1和1:1两种化合物,则W为Na,
①X为Mg,Z、Y形成的稳定化合物为CO2,二者反应生成MgO与碳,反应方程式为:2Mg+CO2
| ||
| ||
②金属性Mg<Na,金属性越强,最高价氧化物对应水化物的碱性越强,故碱性:Mg(OH)2<NaOH,故答案为:Mg(OH)2<NaOH;
③同周期自左而右原子半径减小,同主族自上而下原子半径增大,故原子半径:Na>Mg>C>O,故答案为:Na>Mg>C>O.
点评:本题考查元素周期表与元素周期律,侧重对元素周期律与化学用语的考查,需要学生熟练掌握基础知识,难度不大.

练习册系列答案
相关题目
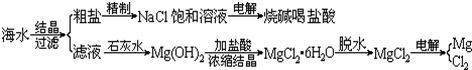
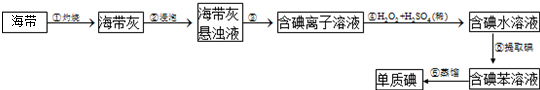
从海水中提取镁的主要步骤
①把贝壳烧成生石灰;
②在海水中加入生石灰,过滤,洗涤沉淀物;
③将沉淀物与盐酸反应,结晶,过滤;
④在氯化氢热气流中加热晶体
⑤电解上述所得盐(熔融条件下)
下列说法不正确的是( )
①把贝壳烧成生石灰;
②在海水中加入生石灰,过滤,洗涤沉淀物;
③将沉淀物与盐酸反应,结晶,过滤;
④在氯化氢热气流中加热晶体
⑤电解上述所得盐(熔融条件下)
下列说法不正确的是( )
| A、上述变化包括分解反应,化合反应,复分解反应类型 |
| B、贝壳烧成生石灰属于吸热反应 |
| C、在氯化氢热气流中干燥晶体的目的是为了抑制阳离子的水解 |
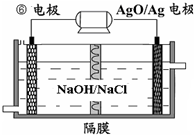
| D、步骤⑤也可以采用电解该盐水溶液的方法 |
下列物物质中,可证明某晶体是离子晶体的是( )
| A、易溶于水 |
| B、晶体不导电,熔化时能导电 |
| C、熔点较高 |
| D、晶体不导电,水溶液能导电 |