题目内容
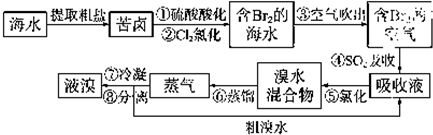
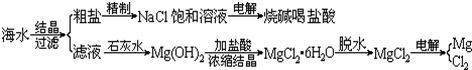
大海是资源的宝库,从海水中可以提取各种化工原料.如图是工业上对海水的几项综合利用的示意图:
试回答下列问题:
(1)粗盐中含有Ca2+、Mg2+、SO42-等杂质,精制时所用试剂为:①盐酸;②BaCl2溶液;③NaOH溶液;④Na2CO3溶液.加入试剂的顺序是
(2)电解饱和食盐水时,与电源正极相连的电极上发生的反应为
与电源负极线连的电极附近溶液pH (变大、不变、变小).若1mol电子的电量为96500C,则用电流强度为100A的稳恒电流持续电解3分13秒,则在两极上共可收集到气体 mL(S.T.P).若保证电解后饱和食盐水的浓度不变,则可采取的方法是
(3)由MgCl2?6H2O晶体脱水制无水MgCl2时,MgCl2?6H2O晶体在 气氛中加热脱水,该气体的作用是
(4)电解无水MgCl2所得的镁蒸气可以在下列 气体中冷却.
A.H2 B.N2 C.CO2 D.O2 E.Ar.

试回答下列问题:
(1)粗盐中含有Ca2+、Mg2+、SO42-等杂质,精制时所用试剂为:①盐酸;②BaCl2溶液;③NaOH溶液;④Na2CO3溶液.加入试剂的顺序是
(2)电解饱和食盐水时,与电源正极相连的电极上发生的反应为
与电源负极线连的电极附近溶液pH
(3)由MgCl2?6H2O晶体脱水制无水MgCl2时,MgCl2?6H2O晶体在
(4)电解无水MgCl2所得的镁蒸气可以在下列
A.H2 B.N2 C.CO2 D.O2 E.Ar.
考点:海水资源及其综合利用,电解原理,物质分离和提纯的方法和基本操作综合应用
专题:实验题,电化学专题,卤族元素
分析:(1)根据镁离子用氢氧根离子沉淀,硫酸根离子用钡离子沉淀,钙离子用碳酸根离子沉淀,过滤要放在所有的沉淀操作之后,加碳酸钠要放在加氯化钡之后,可以将过量的钡离子沉淀最后再用盐酸处理溶液中的碳酸根离子和氢氧根离子进行分析;
(2)根据电解池的工作原理,分析两个电极上放电的离子,并确定生成的物质,依据电解过程中出什么加什么的原则分析恢复溶液浓度;
(3)直接加热MgCl2?3H2O晶体得不到无水MgCl2的原因是,加热生成的水中氯化镁水解生成氢氧化镁,得不到氯化镁,应在HCl气流中加热,抑制镁离子水解;
(4)根据能和金属镁发生反应的气体不能用来做冷却气体来回答;
(2)根据电解池的工作原理,分析两个电极上放电的离子,并确定生成的物质,依据电解过程中出什么加什么的原则分析恢复溶液浓度;
(3)直接加热MgCl2?3H2O晶体得不到无水MgCl2的原因是,加热生成的水中氯化镁水解生成氢氧化镁,得不到氯化镁,应在HCl气流中加热,抑制镁离子水解;
(4)根据能和金属镁发生反应的气体不能用来做冷却气体来回答;
解答:
解:(1)因用蒸发结晶的方法可以从海水中获得食盐,镁离子用氢氧根离子沉淀,加入过量的石灰乳可以将镁离子沉淀,硫酸根离子用钡离子沉淀,加入过量的氯化钡可以将硫酸根离子沉淀,至于先除镁离子,还是先除硫酸根离子都行,钙离子用碳酸根离子沉淀,除钙离子加入碳酸钠转化为沉淀,但是加入的碳酸钠要放在加入的氯化钡之后,这样碳酸钠会除去反应剩余的氯化钡,离子都沉淀了,在进行过滤,最后再加入盐酸除去反应剩余的氢氧根离子和碳酸根离子,所以添加试剂的顺序为②③④①或③②④①,故答案为:②③④①或③②④①;
(2)电解饱和食盐水时,与正极相连的阳极发生的反应是2Cl--2e→Cl2,与负极相连的阴极发生的反应是:2H++2e→H2.H+不断消耗,使得溶液中[OH-]增大,pH变大;
若1mol电子的电量为96500C,则用电流强度为100A的稳恒电流持续电解3分13秒,电解过程中电量=100A×193s=19300C,电子转移物质的量=0.2mol,阳极发生的反应是2Cl--2e→Cl2,与负极相连的阴极发生的反应是:2H++2e→H2.则在两极上共可收集到气体标准状况体积=(0.1mol+0.1mol)×22.4L/mol=4.480L=4480ml;
电解中外溢的是Cl2、H2,所以要确保原溶液浓度不变,只能向体系中通入一定量的HCl气体以补足损失的H、Cl原子;
故答案为:2Cl--2e-═Cl2↑,变大,4480,通入一定量的HCl气体;
(3)直接加热MgCl2?3H2O晶体得不到无水MgCl2的原因是,加热生成的水中氯化镁水解生成氢氧化镁,得不到氯化镁,MgCl2?6H2O晶体在HCL气流中加热脱水,在干燥的HCl气流中,抑制了MgCl2水解,且带走MgCl2,6H2O受热产生的水汽,故能得到无水MgCl2;该气体的作用是抑制水解平衡MgCl2+H2O?Mg(OH)Cl+HCl正向进行;
故答案为:HCl,抑制水解平衡MgCl2+H2O?Mg(OH)Cl+HCl正向进行;
(4)能和金属镁发生反应的气体:氮气、氧气、二氧化碳,所以可以用氢气、氩气做镁蒸气的冷却剂,故选AE;
故答案为:AE;
(2)电解饱和食盐水时,与正极相连的阳极发生的反应是2Cl--2e→Cl2,与负极相连的阴极发生的反应是:2H++2e→H2.H+不断消耗,使得溶液中[OH-]增大,pH变大;
若1mol电子的电量为96500C,则用电流强度为100A的稳恒电流持续电解3分13秒,电解过程中电量=100A×193s=19300C,电子转移物质的量=0.2mol,阳极发生的反应是2Cl--2e→Cl2,与负极相连的阴极发生的反应是:2H++2e→H2.则在两极上共可收集到气体标准状况体积=(0.1mol+0.1mol)×22.4L/mol=4.480L=4480ml;
电解中外溢的是Cl2、H2,所以要确保原溶液浓度不变,只能向体系中通入一定量的HCl气体以补足损失的H、Cl原子;
故答案为:2Cl--2e-═Cl2↑,变大,4480,通入一定量的HCl气体;
(3)直接加热MgCl2?3H2O晶体得不到无水MgCl2的原因是,加热生成的水中氯化镁水解生成氢氧化镁,得不到氯化镁,MgCl2?6H2O晶体在HCL气流中加热脱水,在干燥的HCl气流中,抑制了MgCl2水解,且带走MgCl2,6H2O受热产生的水汽,故能得到无水MgCl2;该气体的作用是抑制水解平衡MgCl2+H2O?Mg(OH)Cl+HCl正向进行;
故答案为:HCl,抑制水解平衡MgCl2+H2O?Mg(OH)Cl+HCl正向进行;
(4)能和金属镁发生反应的气体:氮气、氧气、二氧化碳,所以可以用氢气、氩气做镁蒸气的冷却剂,故选AE;
故答案为:AE;
点评:本题考查了实验探究物质性质的分析判断,实验基本操作和注意问题,物质质量测定的实验方案设计,掌握基础是关键,题目难度中等.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
实验中需2mol/L的Na2CO3溶液950mL,配制时应选用的容量瓶的规格和称取Na2CO3?10H2O的质量分别是( )
| A、1000mL,212g |
| B、950mL,543.4g |
| C、1000mL,572g |
| D、500mL,286g |