题目内容
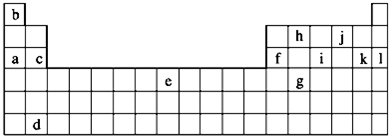
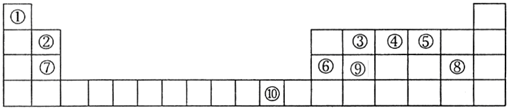
下表为元素周期表的一部分,其中的序号代表对应的元素.
(1)在元素③与①形成的水果催熟剂气体化合物中,元素③为 杂化;根据对角线规则,②和 性质相似(填元素符号).
(2)元素④的第一电离能 元素⑤(填写“>”“=”或“<”)的第一电离能;元素④与元素①形成的最简单分子X的电子式为 .
(3)将过量的X通入含有元素⑩的蓝色硫酸盐溶液中,总反应的离子方程式为 .
(4)⑥-AgO电池是应用广泛的鱼雷电池,其原理如图所示.
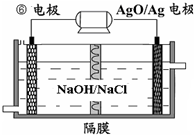
该电池的负极反应式是 .
(6)⑧(Z)和⑨(W)比较,非金属性较弱的是 (填元素符号),下列可以验证这一结论的是 (填序号).
a.元素在地壳中的含量
b.最高价氧化物对应水化物的酸性
c.断开氢化物中1mol H-Z或H-W键所需的能量
d.Z与W以共价键形成化合物时,Z或W显示的电性.

(1)在元素③与①形成的水果催熟剂气体化合物中,元素③为
(2)元素④的第一电离能
(3)将过量的X通入含有元素⑩的蓝色硫酸盐溶液中,总反应的离子方程式为
(4)⑥-AgO电池是应用广泛的鱼雷电池,其原理如图所示.

该电池的负极反应式是
(6)⑧(Z)和⑨(W)比较,非金属性较弱的是
a.元素在地壳中的含量
b.最高价氧化物对应水化物的酸性
c.断开氢化物中1mol H-Z或H-W键所需的能量
d.Z与W以共价键形成化合物时,Z或W显示的电性.
考点:元素周期律和元素周期表的综合应用,非金属在元素周期表中的位置及其性质递变的规律,化学电源新型电池
专题:元素周期律与元素周期表专题,电化学专题
分析:由元素在周期表中位置,可知①为H、②为Be、③为C、④为N、⑤为O、⑥为Al、⑦为Mg、⑧Cl、⑨为Si、⑩为Cu.
(1)元素③与①形成的水果催熟剂气体化合物为C2H4,根据C原子所处σ键数目及孤电子对数确定杂化轨道数目,判断C原子杂化方式;根据对角线规则,②和Al的性质相似;
(2)N元素2p能级容纳3个电子,为半满稳定状态,能量较低,第一电离能高于O元素;元素④与元素①形成的最简单分子X为NH3,分子中N原子与H原子之间形成1对共用电子对;
(3)氨气通入硫酸铜反应得到四氨合铜络离子;
(4)该装置是原电池,铝作负极,负极上铝失电子,碱性条件下生成偏铝酸根与水;
(5)同周期自左而右元素非金属性增强;
a.元素在地壳中的含量不能说明非金属性强弱;
b.非金属性越强,最高价氧化物对应水化物的酸性越强;
c.断开需要能量越多,说明化学键越稳定,则氢化物越稳定;
d.非金属性越强,对共用电子对吸引越强.
(1)元素③与①形成的水果催熟剂气体化合物为C2H4,根据C原子所处σ键数目及孤电子对数确定杂化轨道数目,判断C原子杂化方式;根据对角线规则,②和Al的性质相似;
(2)N元素2p能级容纳3个电子,为半满稳定状态,能量较低,第一电离能高于O元素;元素④与元素①形成的最简单分子X为NH3,分子中N原子与H原子之间形成1对共用电子对;
(3)氨气通入硫酸铜反应得到四氨合铜络离子;
(4)该装置是原电池,铝作负极,负极上铝失电子,碱性条件下生成偏铝酸根与水;
(5)同周期自左而右元素非金属性增强;
a.元素在地壳中的含量不能说明非金属性强弱;
b.非金属性越强,最高价氧化物对应水化物的酸性越强;
c.断开需要能量越多,说明化学键越稳定,则氢化物越稳定;
d.非金属性越强,对共用电子对吸引越强.
解答:
解:由元素在周期表中位置,可知①为H、②为Be、③为C、④为N、⑤为O、⑥为Al、⑦为Mg、⑧Cl、⑨为Si、⑩为Cu.
(1)元素③与①形成的水果催熟剂气体化合物为C2H4,分子中C原子成2个C-H键、1个C=C,没有孤对电子,故杂化轨道数目为3,C原子采取sp2杂化;根据对角线规则,②和Al的性质相似,
故答案为:sp2;Al;
(2)N元素2p能级容纳3个电子,为半满稳定状态,能量较低,第一电离能高于O元素;元素④与元素①形成的最简单分子X为NH3,分子中N原子与H原子之间形成1对共用电子对,电子式为: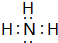 ,
,
故答案为:>;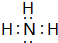 ;
;
(3)氨气通入硫酸铜反应得到四氨合铜络离子,总反应离子方程式为:Cu2++4NH3=[Cu(NH3)4]2+,故答案为:Cu2++4NH3=[Cu(NH3)4]2+;
(4)该装置是原电池,铝作负极,负极上铝失电子,碱性条件下生成偏铝酸根与水,负极电极反应式为:Al+4OH--3e-=AlO2-+2H2O,故答案为:Al+4OH--3e-=AlO2-+2H2O;
(5)同周期自左而右元素非金属性增强,故非金属性Cl>Si;
a.元素在地壳中的含量不能说明非金属性强弱,故a错误;
b.非金属性越强,最高价氧化物对应水化物的酸性越强,故b正确;
c.断开氢化物中1molH-X键需要能量越多,说明化学键越稳定,则氢化物越稳定,故c正确;
d.非金属性越强,对共用电子对吸引越强,元素表现不同的电性,故d正确,
故答案为:Si;bcd.
(1)元素③与①形成的水果催熟剂气体化合物为C2H4,分子中C原子成2个C-H键、1个C=C,没有孤对电子,故杂化轨道数目为3,C原子采取sp2杂化;根据对角线规则,②和Al的性质相似,
故答案为:sp2;Al;
(2)N元素2p能级容纳3个电子,为半满稳定状态,能量较低,第一电离能高于O元素;元素④与元素①形成的最简单分子X为NH3,分子中N原子与H原子之间形成1对共用电子对,电子式为:
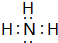 ,
,故答案为:>;
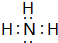 ;
;(3)氨气通入硫酸铜反应得到四氨合铜络离子,总反应离子方程式为:Cu2++4NH3=[Cu(NH3)4]2+,故答案为:Cu2++4NH3=[Cu(NH3)4]2+;
(4)该装置是原电池,铝作负极,负极上铝失电子,碱性条件下生成偏铝酸根与水,负极电极反应式为:Al+4OH--3e-=AlO2-+2H2O,故答案为:Al+4OH--3e-=AlO2-+2H2O;
(5)同周期自左而右元素非金属性增强,故非金属性Cl>Si;
a.元素在地壳中的含量不能说明非金属性强弱,故a错误;
b.非金属性越强,最高价氧化物对应水化物的酸性越强,故b正确;
c.断开氢化物中1molH-X键需要能量越多,说明化学键越稳定,则氢化物越稳定,故c正确;
d.非金属性越强,对共用电子对吸引越强,元素表现不同的电性,故d正确,
故答案为:Si;bcd.
点评:本题考查元素周期表与元素周期律的综合应用,(4)中原电池负极电极反应式的书写为易错点,注意掌握金属性、非金属性强弱比较与实验事实,难度中等.

练习册系列答案
 作业辅导系列答案
作业辅导系列答案 同步学典一课多练系列答案
同步学典一课多练系列答案 经典密卷系列答案
经典密卷系列答案
相关题目