题目内容
4.称取两份铝粉,第一份加足量NaOH溶液,第二份加足量硫酸,如果要得到相同体积(同温同压)的氢气,两份铝粉的质量比是( )| A. | 1:1 | B. | 1:3 | C. | 3:2 | D. | 1:2 |
分析 Al与氢氧化钠溶液反应生成偏铝酸钠与氢气,Al与硫酸反应生成硫酸铝与氢气,反应中Al的化合价均由0价升高为+3价,反应生成氢气相等,根据电子转移守恒可知消耗Al相等.
解答 解:Al与氢氧化钠溶液反应生成偏铝酸钠与氢气,Al与硫酸反应生成硫酸铝与氢气,氢氧化钠、硫酸均足量,Al完全反应,反应中Al的化合价均由0价升高为+3价,反应生成氢气相等,根据电子转移守恒可知消耗Al相等,即两份铝粉的质量比是1:1,
故选:A.
点评 本题考查化学方程式计算,难度不大,明确反应的反应即可解答,利用电子转移守恒可以迅速判断.

练习册系列答案
相关题目
14.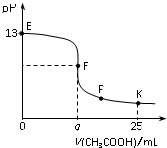 25℃时,在25 mL 0.1 mol/L的NaOH溶液中逐滴加入0.2mol/L CH3COOH溶液,混合溶液pH的变化曲线如图所示,下列分析结论正确的是( )
25℃时,在25 mL 0.1 mol/L的NaOH溶液中逐滴加入0.2mol/L CH3COOH溶液,混合溶液pH的变化曲线如图所示,下列分析结论正确的是( )
 25℃时,在25 mL 0.1 mol/L的NaOH溶液中逐滴加入0.2mol/L CH3COOH溶液,混合溶液pH的变化曲线如图所示,下列分析结论正确的是( )
25℃时,在25 mL 0.1 mol/L的NaOH溶液中逐滴加入0.2mol/L CH3COOH溶液,混合溶液pH的变化曲线如图所示,下列分析结论正确的是( )| A. | a=12.5,且混合溶液pH=7 | |
| B. | 对应曲线上E、F之间的任何一点,溶液中都有c(Na+)>c(CH3COO-)>c(OH-)>c(H+) | |
| C. | P点时,c(CH3COO-)>c(Na+)>c(H+)=c(OH-) | |
| D. | K点时,c(CH3COO-)+c(CH3COOH)=2c(Na+) |
12.下列说法不正确的是( )
| A. | 乙烯与水反应制乙醇、乙醇与氧气反应制乙醛都属于加成反应 | |
| B. | 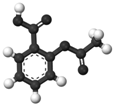 图为阿司匹林的球棍模型,其分子式是C9H8O4 | |
| C. | CH≡CH通过加聚反应可以得到结构片段为“…-CH=CH-CH=CH-…”的高分子化合物 | |
| D. | 往蛋白质溶液中加入饱和(NH4)2SO4溶液、CuSO4溶液都能产生沉淀,其原理不相同 |
19.下列反应中,既属于氧化还原反应又属于置换反应的是( )
| A. | Fe2O3+3CO═2Fe+3CO2 | B. | Ca(OH)2+CO2═CaCO3↓+H2O | ||
| C. | CuO+H2═Cu+H2O | D. | 2Na+Cl2═2NaCl |
9.根据反应:2FeCl3+2KI=2FeCl2+2KCl+I2;2FeCl2+Cl2=2FeCl3.判断下列物质的氧化性由强到弱的顺序是( )
| A. | Cl2>Fe3+>I2 | B. | Fe3+>Cl2>I2 | C. | Fe3+>I2>Cl2 | D. | Cl2>I2>Fe3+ |
13.下列说法错误的是( )
| A. | 氢氧化钠溶液应保存在带磨砂玻璃塞的无色细口瓶中 | |
| B. | 二氧化硅是制造光导纤维的材料 | |
| C. | 水玻璃可用作木材防火剂 | |
| D. | 氢氟酸能与二氧化硅反应,因此可用于刻蚀玻璃 |
14.下表中实验操作、现象和所得出的结论均正确的是
( )
| 选项 | 实验操作 | 实验现象 | 结论 |
| A | 将KI和FeCl3溶液在试管中混合后,滴加KSCN溶液 | 溶液变红色 | 氧化性:Fe2+>I2 |
| B | 少量的乙烯通入pH=3的溴水中 | 溴水褪色,pH基本不变 | 两者发生的加成反应 |
| C | 向某溶液中滴加稀NaOH溶液,将湿润红色石蕊试纸置于试管口 | 试纸不变蓝 | 溶液中一定无NH4+ |
| D | 等体积pH=3的HA和HB两种酸分别与足量的锌反应,排水法收集气体 | HA放出的氢气多且反应速率快 | HA酸性比HB强 |
| A. | A | B. | B | C. | C | D. | D |
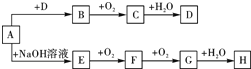 A~H等8种物质存在如下转化关系(反应条件,部分产物未标出).已知:A是正盐,B是能使品红溶液褪色的气体,G是红棕色气体.按要求回答问题:
A~H等8种物质存在如下转化关系(反应条件,部分产物未标出).已知:A是正盐,B是能使品红溶液褪色的气体,G是红棕色气体.按要求回答问题: