题目内容
13.下列说法错误的是( )| A. | 氢氧化钠溶液应保存在带磨砂玻璃塞的无色细口瓶中 | |
| B. | 二氧化硅是制造光导纤维的材料 | |
| C. | 水玻璃可用作木材防火剂 | |
| D. | 氢氟酸能与二氧化硅反应,因此可用于刻蚀玻璃 |
分析 A.氢氧化钠能够与玻璃中二氧化硅反应,不能使用玻璃塞;
B.二氧化硅为光导纤维的材料,硅为半导体材料;
C.水玻璃为硅酸钠水溶液,硅酸钠性质稳定,不燃烧,可作防火材料;
D.玻璃的成分主要是硅酸盐和二氧化硅,氢氟酸和二氧化硅反应.
解答 解:A.氢氧化钠溶液能够与二氧化硅反应,盛放氢氧化钠溶液的试剂瓶的瓶塞不能使用玻璃塞,应该使用橡胶塞,故A错误;
B.硅为半导体材料,二氧化硅为光导纤维的材料,故B正确;
C.水玻璃为硅酸钠的溶液,可用作木材的防火剂,故C正确;
D.玻璃的成分主要是硅酸盐和二氧化硅,氢氟酸和二氧化硅反应;可用于刻蚀玻璃,故D正确;
故选A.
点评 本题考查了化学试剂的存放、硅与二氧化硅的性质与用途,题目难度不大,注意掌握常见化学试剂的性质及存放方法,明确硅与二氧化硅的用途.

练习册系列答案
相关题目
4.称取两份铝粉,第一份加足量NaOH溶液,第二份加足量硫酸,如果要得到相同体积(同温同压)的氢气,两份铝粉的质量比是( )
| A. | 1:1 | B. | 1:3 | C. | 3:2 | D. | 1:2 |
1.在下列各溶液中,离子一定能大量共存的是( )
| A. | 室温下,pH=3的溶液中:AlO2-、Al3+、Cl-、SO42- | |
| B. | 含有大量Fe3+的溶液中:K+、Mg2+、S2-、NO3- | |
| C. | 由水电离的c(H+)=10-11 mol•L-1的溶液中,K+、Na+、Cl-、SO42- | |
| D. | c(H+)<c(OH-)的溶液中:Na+、NH4+、CO32-、S2- |
8.设NA为阿伏加德罗常数的值,下列说法正确的是( )
| A. | 常温常压下,78g Na2O2含有的阴离子数为NA | |
| B. | 常温常压下,22.4 L氢气中含氢原子数目为2 NA | |
| C. | 0.5 mol/L的NaCl溶液中,含有Cl-数目为0.5 NA | |
| D. | 1mol Fe在足量氯气中完全反应,失去的电子数为2 NA |
18.甲烷分子中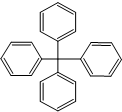 的4个氢原子全部被苯基取代,可得如图所示的分子,对该分子的描述不正确的是( )
的4个氢原子全部被苯基取代,可得如图所示的分子,对该分子的描述不正确的是( )
 的4个氢原子全部被苯基取代,可得如图所示的分子,对该分子的描述不正确的是( )
的4个氢原子全部被苯基取代,可得如图所示的分子,对该分子的描述不正确的是( )| A. | 分子式为C25H20 | B. | 所有碳原子都在同一平面上 | ||
| C. | 是共价化合物 | D. | 是纯净物 |
5.A、B、C、D为原子序数依次增大的短周期主族元素,B2-和D3+的电子层结构相同,A-的电子层结构与氦相同,C是同周期原子半径最大的元素,下列说法错误的是( )
| A. | 离子半径:B2->D3+ | |
| B. | 最高价氧化物对应的水化物碱性:C>D | |
| C. | 失电子能力:A>C | |
| D. | A与B可形成共价化合物:A2B、A2B2 |
3.除去乙醇中的少量水可选用的方法是( )
| A. | 盐析 | B. | 分液 | C. | 蒸馏 | D. | 过滤 |