题目内容
16.下列化合物:①HCl ②NaOH ③CH3COOH ④NH3•H2O ⑤CH3COONa ⑥NH4Cl(1)溶液呈碱性的有②④⑤(填序号).
(2)常温下0.01mol/L HCl溶液的PH=2;
(3)常温下PH=11的CH3COONa溶液中由水电离产生的c(OH-)=10-3 mol/L.
(4)用离子方程式表示CH3COONa溶液呈碱性的原因CH3COO-+H2O?CH3COOH+OH-.
分析 (1)碱或强碱弱酸盐其溶液都呈碱性;
(2)pH=-lgc(H+);
(3)醋酸钠促进水电离,根据氢离子浓度结合水的离子积常数计算氢氧根离子浓度;
(4)醋酸根离子在溶液中水解生成氢氧根离子,溶液显碱性;
解答 解:(1)碱或强碱弱酸盐其溶液都呈碱性,氢氧化钠和氨水、醋酸钠溶液都呈碱性,
故答案为:②④⑤;
(2)常温下0.01mol/L HCl溶液中c(H+)=0.01mol/L,pH=-lgc(H+)=-lg0.01=2,故答案为:2;
(3)醋酸钠促进水电离,醋酸钠溶液中氢离子浓度为10-11mol/L,根据水的离子积常数知,氢氧根离子浓度等于10-3 mol/L,
故答案为:10-3 mol/L;
(4)醋酸根离子在溶液中水解生成氢氧根离子,溶液显碱性,其水解离子方程式为:CH3COO-+H2O?CH3COOH+OH-;
故答案为:CH3COO-+H2O?CH3COOH+OH-;
点评 本题考查了弱电解质的电离、溶液PH计算等知识点,根据弱电解质电离特点来分析解答,明确盐类水解实质是解本题关键,题目难度不大.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
7.二氧化锰是制造锌锰干电池的基本材料.工业上以软锰矿为原料,利用硫酸亚铁制备高纯二氧化锰的流程如下:
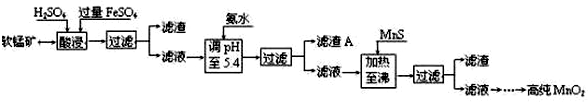
某软锰矿的主要成分为MnO2,还含有Si(16.27%)、Fe(5.86%)、Al(3.42%)、Zn(2.68%)和Cu(0.86%)等元素的化合物.部分阳离子以氢氧化物或硫化物的形式完全沉淀时溶液的pH见下表,回答下列问题:
(1)硫酸亚铁在酸性条件下将MnO2还原为MnSO4,酸浸时发生的主要反应的化学方程式为MnO2+2FeSO4+2H2SO4=MnSO4+Fe2(SO4)3+2H2O.
(2)滤渣A的主要成分是Fe(OH)3和Al(OH)3.
(3)加入MnS的目的是除去Cu2+、Zn2+杂质.
(4)碱性锌锰电池中,MnO2参与的电极反应方程式为MnO2+H2O+e-=MnOOH+OH-(或2MnO2+H2O+2e-=Mn2O3+2OH-).
(5)从废旧碱性锌锰电池中可以回收利用的物质有锌、二氧化锰(写两种).

某软锰矿的主要成分为MnO2,还含有Si(16.27%)、Fe(5.86%)、Al(3.42%)、Zn(2.68%)和Cu(0.86%)等元素的化合物.部分阳离子以氢氧化物或硫化物的形式完全沉淀时溶液的pH见下表,回答下列问题:
| 沉淀物 | Al(OH)3 | Fe(OH)3 | Fe(OH)2 | Mn(OH)2 | Cu(OH)2 | Zn(OH)2 | CuS | ZnS | MnS | FeS |
| pH | 5.2 | 3.2 | 9.7 | 10.4 | 6.7 | 8.0 | ≥-0.42 | ≥2.5 | ≥7 | ≥7 |
(2)滤渣A的主要成分是Fe(OH)3和Al(OH)3.
(3)加入MnS的目的是除去Cu2+、Zn2+杂质.
(4)碱性锌锰电池中,MnO2参与的电极反应方程式为MnO2+H2O+e-=MnOOH+OH-(或2MnO2+H2O+2e-=Mn2O3+2OH-).
(5)从废旧碱性锌锰电池中可以回收利用的物质有锌、二氧化锰(写两种).
4.称取两份铝粉,第一份加足量NaOH溶液,第二份加足量硫酸,如果要得到相同体积(同温同压)的氢气,两份铝粉的质量比是( )
| A. | 1:1 | B. | 1:3 | C. | 3:2 | D. | 1:2 |
11.下列离子方程式书写正确的是( )
| A. | 铝粉投入到NaOH溶液中:2Al+2OH-═2AlO2-+H2↑ | |
| B. | 铁和稀硝酸反应:Fe+2H+═Fe2++H2↑ | |
| C. | AlCl3溶液中加入足量的氨水:Al3++3OH-═Al(OH)3↓ | |
| D. | FeCl2溶液跟Cl2反应:2Fe2++Cl2═2Fe3++2Cl- |
1.在下列各溶液中,离子一定能大量共存的是( )
| A. | 室温下,pH=3的溶液中:AlO2-、Al3+、Cl-、SO42- | |
| B. | 含有大量Fe3+的溶液中:K+、Mg2+、S2-、NO3- | |
| C. | 由水电离的c(H+)=10-11 mol•L-1的溶液中,K+、Na+、Cl-、SO42- | |
| D. | c(H+)<c(OH-)的溶液中:Na+、NH4+、CO32-、S2- |
8.设NA为阿伏加德罗常数的值,下列说法正确的是( )
| A. | 常温常压下,78g Na2O2含有的阴离子数为NA | |
| B. | 常温常压下,22.4 L氢气中含氢原子数目为2 NA | |
| C. | 0.5 mol/L的NaCl溶液中,含有Cl-数目为0.5 NA | |
| D. | 1mol Fe在足量氯气中完全反应,失去的电子数为2 NA |
5.A、B、C、D为原子序数依次增大的短周期主族元素,B2-和D3+的电子层结构相同,A-的电子层结构与氦相同,C是同周期原子半径最大的元素,下列说法错误的是( )
| A. | 离子半径:B2->D3+ | |
| B. | 最高价氧化物对应的水化物碱性:C>D | |
| C. | 失电子能力:A>C | |
| D. | A与B可形成共价化合物:A2B、A2B2 |
6.2015年,我国科学家屠呦呦因在青蒿素发现和治疗中的贡献,获得了诺贝尔生理学或医学奖.由植物黄花蒿叶中提取的青蒿素还可合成用于抗氯喹恶性疟及凶险型疟疾的蒿甲醚,其合成路线如下:
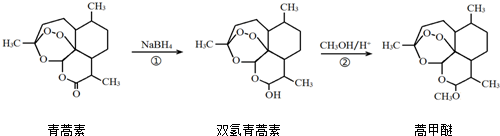
下列说法正确的是( )

下列说法正确的是( )
| A. | 青蒿素的分子式是C15H21O4 | |
| B. | 青蒿素在NaOH溶液中可以发生水解反应 | |
| C. | 反应②有H2O生成 | |
| D. | 反应①氧化反应 |