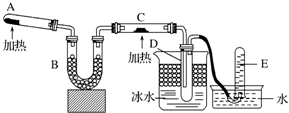
题目内容
9.根据反应:2FeCl3+2KI=2FeCl2+2KCl+I2;2FeCl2+Cl2=2FeCl3.判断下列物质的氧化性由强到弱的顺序是( )| A. | Cl2>Fe3+>I2 | B. | Fe3+>Cl2>I2 | C. | Fe3+>I2>Cl2 | D. | Cl2>I2>Fe3+ |
分析 根据反应方程式进行比较:氧化剂+还原剂=还原产物+氧化产物 氧化性:氧化剂>氧化产物;还原性:还原剂>还原产物,据此分析.
解答 解:根据①反应可知氧化剂为FeCl3、还原剂为KI、还原产物为FeCl2、氧化产物为I2,所以氧化性:FeCl3>I2,还原性为:
KI>FeCl2.根据②可知,氧化剂Cl2、氧化产物为FeCl3、还原剂FeCl2、还原产物为2FeCl3,所以氧化性:Cl2>FeCl3,还原性为:FeCl2>2FeCl3.
故氧化性顺序为::Cl2>FeCl3>I2,即Cl2>Fe3+>I2,
故选A.
点评 本题考查了氧化还原反应,侧重于根据方程式来比较氧化性和还原性的考查,解题的关键是根据化合价找出氧化剂、还原剂、氧化产物和还原产物,题目难度不大.

练习册系列答案
相关题目
20.下列液体混合后,常温下溶液一定呈碱性的是( )
| A. | pH=8的氢氧化钠溶液1mL与999mL水混合 | |
| B. | pH=12的氢氧化钠溶液与pH=2的某酸溶液等体积混合 | |
| C. | pH=2的盐酸与0.01mol/L的氨水等体积混合 | |
| D. | 1×10-3mol/L的盐酸和4×10-4mol/L的Ba(OH)2溶液各取10mL,混合后再稀释100倍 |
17.如图甲所示,纯电动公交车逐渐成为杭州街头常见的身影,磷酸铁锂电池是杭州市纯电动公交车所用的电池,现要从废旧磷酸铁锂电池中回收Fe、Al、Li等物质,采用下图乙所示方法.已知:磷酸铁锂电池溶解在H2SO4中含有Fe3+、Al3+、Li+、$S{O_4}^{2-}$、$P{O_4}^{3-}$等离子及少量不溶物,滤液c中含有大量Li+离子,Li2CO3可溶于冷水,不溶于热水.下列说法不正确的是( )
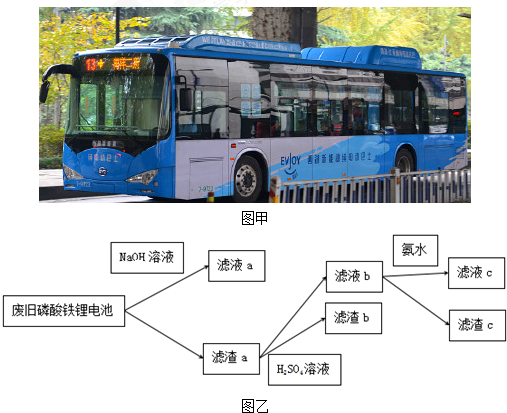

| A. | 向滤液a中加入适量H2SO4溶液,可以得到白色沉淀 | |
| B. | 滤液b中加入氨水的目的是使Fe3+沉淀,滤渣c为红褐色 | |
| C. | 要将Li从溶液中析出,可在滤液c中加入足量Na2CO3溶液,加热浓缩,冷却结晶 | |
| D. | 图中的氨水可以用适量NaOH溶液代替 |
4.称取两份铝粉,第一份加足量NaOH溶液,第二份加足量硫酸,如果要得到相同体积(同温同压)的氢气,两份铝粉的质量比是( )
| A. | 1:1 | B. | 1:3 | C. | 3:2 | D. | 1:2 |
1.在下列各溶液中,离子一定能大量共存的是( )
| A. | 室温下,pH=3的溶液中:AlO2-、Al3+、Cl-、SO42- | |
| B. | 含有大量Fe3+的溶液中:K+、Mg2+、S2-、NO3- | |
| C. | 由水电离的c(H+)=10-11 mol•L-1的溶液中,K+、Na+、Cl-、SO42- | |
| D. | c(H+)<c(OH-)的溶液中:Na+、NH4+、CO32-、S2- |
18.甲烷分子中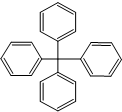 的4个氢原子全部被苯基取代,可得如图所示的分子,对该分子的描述不正确的是( )
的4个氢原子全部被苯基取代,可得如图所示的分子,对该分子的描述不正确的是( )
 的4个氢原子全部被苯基取代,可得如图所示的分子,对该分子的描述不正确的是( )
的4个氢原子全部被苯基取代,可得如图所示的分子,对该分子的描述不正确的是( )| A. | 分子式为C25H20 | B. | 所有碳原子都在同一平面上 | ||
| C. | 是共价化合物 | D. | 是纯净物 |
19.2015年7月31日,中国获得2022年冬奥会主办权,这将促进中国冰雪运动的发展.以下关于冰的说法正确的是( )
| A. | 等质量的0℃冰与0℃的水内能相同 | B. | 冰和可燃冰都是结晶水合物 | ||
| C. | 冰和干冰、水晶的空间结构相似 | D. | 氢键影响冰晶体的体积大小 |
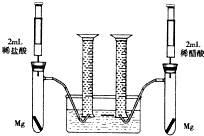 某化学小组为比较盐酸和醋酸的酸性,设计了如下实验方案.装置如图(夹持仪器略):
某化学小组为比较盐酸和醋酸的酸性,设计了如下实验方案.装置如图(夹持仪器略):