题目内容
12.下列说法不正确的是( )| A. | 乙烯与水反应制乙醇、乙醇与氧气反应制乙醛都属于加成反应 | |
| B. | 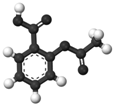 图为阿司匹林的球棍模型,其分子式是C9H8O4 | |
| C. | CH≡CH通过加聚反应可以得到结构片段为“…-CH=CH-CH=CH-…”的高分子化合物 | |
| D. | 往蛋白质溶液中加入饱和(NH4)2SO4溶液、CuSO4溶液都能产生沉淀,其原理不相同 |
分析 A.乙烯中含碳碳双键,与水发生加成反应;乙醇与氧气发生氧化反应生成乙醛;
B.由模型可知,含苯环、-COOH、-COOOCCH3;
C.CH≡CH通过加聚反应生成聚乙烯;
D.加入饱和(NH4)2SO4溶液、CuSO4溶液分别发生盐析、变性.
解答 解:A.乙烯中含碳碳双键,与水发生加成反应;乙醇与氧气发生氧化反应生成乙醛,则反应类型不同,故A错误;
B.由模型可知,含苯环、-COOH、-COOOCCH3,则其分子式是C9H8O4,故B正确;
C.CH≡CH通过加聚反应生成聚乙烯,则结构片段为“…-CH=CH-CH=CH-…”,故C正确;
D.加入饱和(NH4)2SO4溶液、CuSO4溶液分别发生盐析、变性,都能产生沉淀,其原理不相同,故D正确;
故选A.
点评 本题考查有机物的结构与性质,为高考常见题型,侧重于考查学生的分析能力和应用能力,注意把握官能团与性质的关系、有机反应为解答的关键,题目难度不大.

练习册系列答案
相关题目
2.下列离子方程式正确的是( )
| A. | 澄清的石灰水与稀盐酸反应Ca(OH)2+2H+═Ca2++2H2O | |
| B. | 少量金属钠放入冷水中:Na+2H2O═Na++2OH-+H2↑ | |
| C. | 氧化铜溶于硫酸:O2-+2H+═H2O | |
| D. | 碳酸钙溶于醋酸CaCO3+2CH3COOH═Ca2++2CH3COO-+H2O+CO2↑ |
20.下列液体混合后,常温下溶液一定呈碱性的是( )
| A. | pH=8的氢氧化钠溶液1mL与999mL水混合 | |
| B. | pH=12的氢氧化钠溶液与pH=2的某酸溶液等体积混合 | |
| C. | pH=2的盐酸与0.01mol/L的氨水等体积混合 | |
| D. | 1×10-3mol/L的盐酸和4×10-4mol/L的Ba(OH)2溶液各取10mL,混合后再稀释100倍 |
7.二氧化锰是制造锌锰干电池的基本材料.工业上以软锰矿为原料,利用硫酸亚铁制备高纯二氧化锰的流程如下:
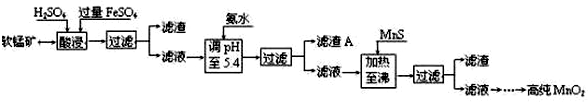
某软锰矿的主要成分为MnO2,还含有Si(16.27%)、Fe(5.86%)、Al(3.42%)、Zn(2.68%)和Cu(0.86%)等元素的化合物.部分阳离子以氢氧化物或硫化物的形式完全沉淀时溶液的pH见下表,回答下列问题:
(1)硫酸亚铁在酸性条件下将MnO2还原为MnSO4,酸浸时发生的主要反应的化学方程式为MnO2+2FeSO4+2H2SO4=MnSO4+Fe2(SO4)3+2H2O.
(2)滤渣A的主要成分是Fe(OH)3和Al(OH)3.
(3)加入MnS的目的是除去Cu2+、Zn2+杂质.
(4)碱性锌锰电池中,MnO2参与的电极反应方程式为MnO2+H2O+e-=MnOOH+OH-(或2MnO2+H2O+2e-=Mn2O3+2OH-).
(5)从废旧碱性锌锰电池中可以回收利用的物质有锌、二氧化锰(写两种).

某软锰矿的主要成分为MnO2,还含有Si(16.27%)、Fe(5.86%)、Al(3.42%)、Zn(2.68%)和Cu(0.86%)等元素的化合物.部分阳离子以氢氧化物或硫化物的形式完全沉淀时溶液的pH见下表,回答下列问题:
| 沉淀物 | Al(OH)3 | Fe(OH)3 | Fe(OH)2 | Mn(OH)2 | Cu(OH)2 | Zn(OH)2 | CuS | ZnS | MnS | FeS |
| pH | 5.2 | 3.2 | 9.7 | 10.4 | 6.7 | 8.0 | ≥-0.42 | ≥2.5 | ≥7 | ≥7 |
(2)滤渣A的主要成分是Fe(OH)3和Al(OH)3.
(3)加入MnS的目的是除去Cu2+、Zn2+杂质.
(4)碱性锌锰电池中,MnO2参与的电极反应方程式为MnO2+H2O+e-=MnOOH+OH-(或2MnO2+H2O+2e-=Mn2O3+2OH-).
(5)从废旧碱性锌锰电池中可以回收利用的物质有锌、二氧化锰(写两种).
17.如图甲所示,纯电动公交车逐渐成为杭州街头常见的身影,磷酸铁锂电池是杭州市纯电动公交车所用的电池,现要从废旧磷酸铁锂电池中回收Fe、Al、Li等物质,采用下图乙所示方法.已知:磷酸铁锂电池溶解在H2SO4中含有Fe3+、Al3+、Li+、$S{O_4}^{2-}$、$P{O_4}^{3-}$等离子及少量不溶物,滤液c中含有大量Li+离子,Li2CO3可溶于冷水,不溶于热水.下列说法不正确的是( )
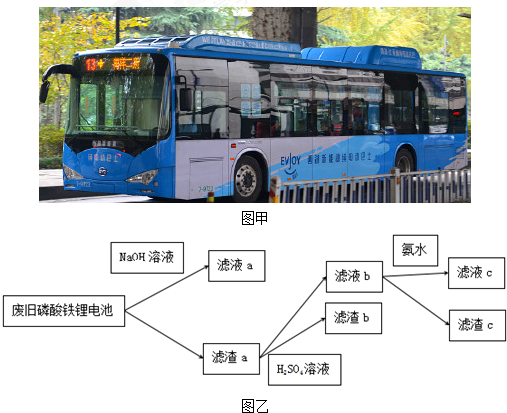

| A. | 向滤液a中加入适量H2SO4溶液,可以得到白色沉淀 | |
| B. | 滤液b中加入氨水的目的是使Fe3+沉淀,滤渣c为红褐色 | |
| C. | 要将Li从溶液中析出,可在滤液c中加入足量Na2CO3溶液,加热浓缩,冷却结晶 | |
| D. | 图中的氨水可以用适量NaOH溶液代替 |
4.称取两份铝粉,第一份加足量NaOH溶液,第二份加足量硫酸,如果要得到相同体积(同温同压)的氢气,两份铝粉的质量比是( )
| A. | 1:1 | B. | 1:3 | C. | 3:2 | D. | 1:2 |
1.在下列各溶液中,离子一定能大量共存的是( )
| A. | 室温下,pH=3的溶液中:AlO2-、Al3+、Cl-、SO42- | |
| B. | 含有大量Fe3+的溶液中:K+、Mg2+、S2-、NO3- | |
| C. | 由水电离的c(H+)=10-11 mol•L-1的溶液中,K+、Na+、Cl-、SO42- | |
| D. | c(H+)<c(OH-)的溶液中:Na+、NH4+、CO32-、S2- |