题目内容
14.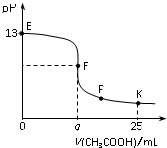 25℃时,在25 mL 0.1 mol/L的NaOH溶液中逐滴加入0.2mol/L CH3COOH溶液,混合溶液pH的变化曲线如图所示,下列分析结论正确的是( )
25℃时,在25 mL 0.1 mol/L的NaOH溶液中逐滴加入0.2mol/L CH3COOH溶液,混合溶液pH的变化曲线如图所示,下列分析结论正确的是( )| A. | a=12.5,且混合溶液pH=7 | |
| B. | 对应曲线上E、F之间的任何一点,溶液中都有c(Na+)>c(CH3COO-)>c(OH-)>c(H+) | |
| C. | P点时,c(CH3COO-)>c(Na+)>c(H+)=c(OH-) | |
| D. | K点时,c(CH3COO-)+c(CH3COOH)=2c(Na+) |
分析 A.若a=12.5,则氢氧化钠与醋酸恰好反应生成醋酸钠,溶液呈碱性,溶液的pH大于7;
B.当滴入的醋酸浓度较小时,可能存在c(OH-)>c(CH3COO-);
C.若c(H+)=c(OH-),根据电荷守恒可知c(CH3COO-)=c(Na+);
D.K点时溶质为等浓度的醋酸和醋酸钠,根据溶液中的物料守恒判断.
解答 解:A.当a12.5时,NaOH和醋酸的物质的量相等,二者恰好反应生成醋酸钠,醋酸根离子部分水解,溶液呈碱性,则溶液得到pH>7,故A错误;
B.开始时滴入较少的醋酸,则氢氧化钠过量,溶液中会满足:c(Na+)>c(OH-)>c(CH3COO-)>c(H+),故B错误;
C.若P点时c(H+)=c(OH-),根据电荷守恒可知c(CH3COO-)=c(Na+),则溶液中正确的离子浓度大小为:c(CH3COO-)=c(Na+)>c(H+)=c(OH-),故C错误;
D.K点时滴入25mL醋酸,反应后溶质为等浓度的醋酸和醋酸钠,根据物料守恒可得:c(CH3COO-)+c(CH3COOH)=2c(Na+),故D正确;
故选D.
点评 本题考查了溶液酸碱混合的定性判断、离子浓度大小比较,题目难度中等,明确溶液酸碱性与溶液pH的关系为解答关键,注意掌握电荷守恒、物料守恒及盐的水解原理的含义及应用方法,试题培养了学生的分析能力及灵活应用能力.

练习册系列答案
相关题目
2.下列离子方程式正确的是( )
| A. | 澄清的石灰水与稀盐酸反应Ca(OH)2+2H+═Ca2++2H2O | |
| B. | 少量金属钠放入冷水中:Na+2H2O═Na++2OH-+H2↑ | |
| C. | 氧化铜溶于硫酸:O2-+2H+═H2O | |
| D. | 碳酸钙溶于醋酸CaCO3+2CH3COOH═Ca2++2CH3COO-+H2O+CO2↑ |
9. 草酸亚铁晶体(FeC2O4•2H2O)呈淡黄色.某课题组为探究草酸业铁晶体的化学性质,进行了一系列实验探究.
草酸亚铁晶体(FeC2O4•2H2O)呈淡黄色.某课题组为探究草酸业铁晶体的化学性质,进行了一系列实验探究.
(1)向盛有草酸亚铁晶体的试管中滴入几滴硫酸酸化的KMnO4溶液,振荡,发现溶液颜色逐渐变为棕黄色,并检测到二氧化碳气体生成.这说明草酸亚铁晶体具有还原性(填“氧化性”、“还原性”或“碱性”).若反应中消耗1mol FeC2O4•2H2O,则参加反应的KMnO4为0.6mol.
(2)资料表明:在密闭容器中加热到一定温度时,草酸亚铁晶体可完全分解,生成几种氧化物,残留物为黑色固体.课题组根据课本上所介绍的铁的氧化物的性质,对黑色固体的组成提出如下假设,请你完成假设二和假设三:
假设一:全部是FeO
假设二:全部是Fe3O4
假设三:是FeO和Fe3O4的混合物
(3)为验证上述假设一是否成立,课题组进行如下研究.
【定性研究】请你完成下表中内容.
【定量研究】课题组在文献中查阅到,FeC2O4•2H2O受热分解时,固体质量随温度变化的曲线如下图所示,写出加热到400℃时,FeC2O4•2H2O晶体受热分解的化学方程式为:FeC2O4•2H2O$\frac{\underline{\;\;△\;\;}}{\;}$FeO+CO↑+CO2↑+2H2O.根据图象,如有1.0g草酸亚铁晶体在坩埚中敞口充分加热,最终残留黑色固体的质量大于0.4g.某同学由此得出结论:假设一不成立.你是否同意该同学的结论,并简述理由:不同意,实验未在密闭容器中进行,FeO会被空气中的氧气进一步氧化,生成铁的其他氧化物.
 草酸亚铁晶体(FeC2O4•2H2O)呈淡黄色.某课题组为探究草酸业铁晶体的化学性质,进行了一系列实验探究.
草酸亚铁晶体(FeC2O4•2H2O)呈淡黄色.某课题组为探究草酸业铁晶体的化学性质,进行了一系列实验探究.(1)向盛有草酸亚铁晶体的试管中滴入几滴硫酸酸化的KMnO4溶液,振荡,发现溶液颜色逐渐变为棕黄色,并检测到二氧化碳气体生成.这说明草酸亚铁晶体具有还原性(填“氧化性”、“还原性”或“碱性”).若反应中消耗1mol FeC2O4•2H2O,则参加反应的KMnO4为0.6mol.
(2)资料表明:在密闭容器中加热到一定温度时,草酸亚铁晶体可完全分解,生成几种氧化物,残留物为黑色固体.课题组根据课本上所介绍的铁的氧化物的性质,对黑色固体的组成提出如下假设,请你完成假设二和假设三:
假设一:全部是FeO
假设二:全部是Fe3O4
假设三:是FeO和Fe3O4的混合物
(3)为验证上述假设一是否成立,课题组进行如下研究.
【定性研究】请你完成下表中内容.
| 实验步骤(不要求写出具体操作过程) | 预期实验现象和结论 |
| 取少量黑色固体,加入适量稀盐酸(或稀硫酸)溶解,在溶液中加入KSCN溶液 | 若溶液不变红色,则假设一成立;若溶液变红色,则假设一不成立 |
4.称取两份铝粉,第一份加足量NaOH溶液,第二份加足量硫酸,如果要得到相同体积(同温同压)的氢气,两份铝粉的质量比是( )
| A. | 1:1 | B. | 1:3 | C. | 3:2 | D. | 1:2 |
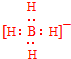 ;V的氢氧化物作弱酸时有类似TR4-的离子产生,其电离方程式为Al(OH)3+H2O?H++[Al(OH)4]-.
;V的氢氧化物作弱酸时有类似TR4-的离子产生,其电离方程式为Al(OH)3+H2O?H++[Al(OH)4]-.
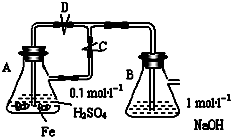
 某化学小组为比较盐酸和醋酸的酸性,设计了如下实验方案.装置如图(夹持仪器略):
某化学小组为比较盐酸和醋酸的酸性,设计了如下实验方案.装置如图(夹持仪器略):