题目内容
7.将10mL0.1mol/L的氨水与5mL0.2mol/L盐酸混和后溶液中离子浓度的关系正确的是( )| A. | c(Cl-)>c(NH4+)>c(OH-)>c(H+) | B. | c(Cl-)>c(NH4+)>c(H+)>c(OH-) | ||
| C. | c(NH4+)>c(Cl-)>c(H+)>c(OH-) | D. | c(H+)>c(Cl-)>c(NH4+)>c(OH-) |
分析 10moL0.1mol/L的氨水中溶质一水合氨的物质的量为:0.1mol/L×0.01L=0.001mol,5mL 0.2mol/L的盐酸中氯化氢的物质的量为:0.2mol/L×0.005L=0.001mol,两溶液混合后恰好完全反应生成0.001mol氯化铵,铵根离子水解显酸性,结合物料守恒、电荷守恒对各选项进行判断.
解答 解:10moL0.1mol/L的氨水中溶质一水合氨的物质的量为:0.1mol/L×0.01L=0.001mol,5mL 0.2mol/L的盐酸中氯化氢的物质的量为:0.2mol/L×0.005L=0.001mol,两溶液混合后恰好完全反应生成0.001mol氯化铵,铵根离子水解显酸性,所以c(H+)>c(OH-),铵根离子水解,所以铵根离子浓度减小,则c(Cl-)>c(NH4+),由于铵根离子水解程度不大,所以溶液中离子浓度关系为:c(Cl-)>c(NH4+)>c(H+)>c(OH-),故B正确;
故选B.
点评 本题考查了离子浓度大小比较,题目难度中等,注意掌握酸碱混合的定性判断,明确反应后溶质组成为解答关键,注意电荷守恒、物料守恒、盐的水解原理在判断离子浓度大小中的应用方法.

练习册系列答案
 一卷搞定系列答案
一卷搞定系列答案 名校作业本系列答案
名校作业本系列答案 轻巧夺冠周测月考直通名校系列答案
轻巧夺冠周测月考直通名校系列答案
相关题目
17.下列说法不正确的是( )
| A. | 常温下pH=11的氨水中,由水电离产生的c (OH-)=10-11mol/L | |
| B. | pH=3的CH3COOH溶液和pH=11的NaOH溶液等体积混合后的溶液中,c (H+)>c (OH-) | |
| C. | NaHCO3溶液中,存在c (H+)=c (OH-)+c (CO32-) | |
| D. | 0.1mol/L的NH4Cl溶液中:c (Cl-)>c (NH4+)>c (H+)>c (OH-) |
2.利用二氧化碳废气生产化工产品是解决室温效应的有效途径之一,对用二氧化碳为主要原料生产的四中产品(如图所示)的相关说法不正确的是 ( )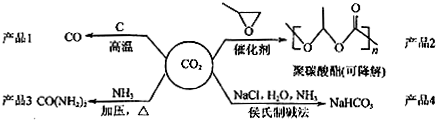

| A. | 反应CO2(g)+C(s)═2CO(g) 的△H>0,△S>0 | |
| B. | 用聚碳酸酯代替聚乙烯等传统塑料,可消除被色污染 | |
| C. | CO(NH2)2与NH4CNO互为同分异构体,两者化学性质相同 | |
| D. | 侯氏制碱法的工艺过程中应用了物质溶解度的差异 |
12.下列各溶液中,微粒的物质的量浓度关系正确的是( )
| A. | 0.1mol/L Na2CO3溶液:c(OH-)+c(H+)═c(HCO3-)+2c(H2CO3) | |
| B. | 0.1mol/L NH4Cl溶液:c(NH4+)+c(Cl-)═0.2mol/L | |
| C. | 向硝酸钠溶液中滴加稀盐酸得到的pH=4的混合溶液:c(Na+)═c(NO3-) | |
| D. | 向醋酸钠溶液中加入适量醋酸,得到的酸性混合溶液c(Na+)>c(CH3COO-)>c(H+)>c(OH-) |
19.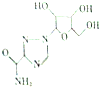 利巴韦林适用于拉萨热、幼儿呼吸道合胞病毒肺炎、带状咆疹等,其结构简式如图,下列关于利巴韦林的说法错误的是( )
利巴韦林适用于拉萨热、幼儿呼吸道合胞病毒肺炎、带状咆疹等,其结构简式如图,下列关于利巴韦林的说法错误的是( )
 利巴韦林适用于拉萨热、幼儿呼吸道合胞病毒肺炎、带状咆疹等,其结构简式如图,下列关于利巴韦林的说法错误的是( )
利巴韦林适用于拉萨热、幼儿呼吸道合胞病毒肺炎、带状咆疹等,其结构简式如图,下列关于利巴韦林的说法错误的是( )| A. | 分子式为C8H12N4O3 | B. | 能使紫色石蕊试液变红 | ||
| C. | 可以发生酯化反应 | D. | 可以与H2发生加成反应 |
16.下列化学用语正确的是( )
| A. | (NH4)2Fe(SO4)2溶解于水:(NH4)2Fe(SO4)2?2NH4++Fe2++2SO42- | |
| B. | Al(OH)3在水中的电离:Al(OH)3?Al3++3OH- | |
| C. | H3PO4溶解于水:H3PO4+3H2O?3H3O++PO43- | |
| D. | NaHSO3在水中的电离:HSO3-+H3O+?SO32-+H2O |
19.室温时,下列混合溶液的pH一定小于7的是( )
| A. | pH=3的盐酸和pH=11的氨水等体积混合 | |
| B. | 0.1mol/L的盐酸和0.1mol/L的氢氧化钡溶液等体积混合 | |
| C. | pH=3的醋酸和pH=11的氢氧化钡溶液等体积混合 | |
| D. | pH=3的硫酸和pH=11的氨水等体积混合 |