题目内容
15.CO、CO2是化石燃料燃烧后的主要产物.(1)将体积比为2:1的CO2和CO混合气体通入有足量Na2O2固体的密闭容器中,同时不断地用电火花点燃.
①生成物的化学式是Na2CO3和O2.
②将残留固体溶于水,所得溶液中2c(CO32-)+c(HCO3-)<c(Na+)(填“>”、“<”或“=”).
(2)已知:2CO(g)+O2(g)=2CO2 (g)△H=-566.0kJ•mol-1;键能EO=O=499.0kJ•mol-1
①CO(g)+O2(g)?CO2 (g)+O(g)的△H=-33.5kJ•mol-1
②已知2500K时,①中反应的平衡常数为0.40.某时刻该反应体系中各物质浓度满足:
c(CO)•c(O2)=c(CO2)•c(O),则此时反应向左(填“向左”或“向右”)进行.
(3)已知:反应CO2 (g)?CO(g)+O(g)在密闭容器中CO2分解实验的结果如图1;反应
2CO2 (g)?2CO(g)+O2(g)中1molCO2在不同温度下的平衡分解量如图2.
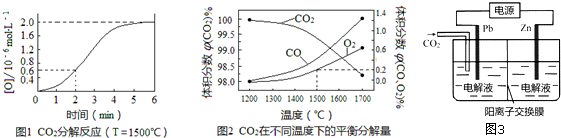
①分析图1,求2min内v(CO2)=3×10-7mol•L-1•min-1.
②分析图2,1500℃时反应达平衡,此时容器体积为1L,则反应的平衡常数K=3.2×10-8 mol•L-1(计算结果保留1位小数).
(4)利用电化学还原CO2制取ZnC2O4的示意图如图3所示,电解液不参加反应,则Zn与电源的正极(填“正”或“负”)相连,Pb极上的电极反应式是2CO2+2e-=C2O42-.
分析 (1)①Na2O2与CO2反应:2CO2+2Na2O2=2Na2CO3+O2,电火花不断引燃,发生反应:2CO+O2 $\frac{\underline{\;点燃\;}}{\;}$2CO2,整个过程相当于CO+Na2O2=Na2CO3,由于加入足量的Na2O2固体,则反应后的气体只能为O2;
②碳酸钠在溶液中水解显碱性,结合溶液中电荷守恒分析;
(2)①已知:2CO(g)+O2(g)=2CO2 (g)△H=-566.0kJ•mol-1;
O2(g)=2O(g)△H=499kJ•mol-1;两个方程相加除以2即可得到CO(g)+O2(g)?CO2 (g)+O(g);
②根据Qc与k的相对大小判断;
(3)①2min内O的浓度增大0.6×10-6mol/L,则二氧化碳减小0.6×10-6mol/L,根据v(CO2)=$\frac{△c}{t}$计算;
②设生成的氧气为xmol,
2CO2 (g)?2CO(g)+O2(g)
起始量(mol):1 0 0
转化量(mol):2x 2x x
平衡量(mol):1-2x 2x x,
平衡时,氧气的体积分数为0.2,则$\frac{x}{1+x}$=0.2%,结合K计算;
(4)Zn在阳极上失电子生成锌离子,Pb电极上CO2得电子生成C2O42-.
解答 解:(1)①Na2O2与CO2反应:2CO2+2Na2O2=2Na2CO3+O2,电火花不断引燃,发生反应:2CO+O2 $\frac{\underline{\;点燃\;}}{\;}$2CO2,整个过程相当于CO+Na2O2=Na2CO3,由于加入足量的Na2O2固体,则反应后的气体只能为O2,所以反应后生成物的化学式是Na2CO3、O2;
故答案为:Na2CO3、O2;
②碳酸钠在溶液中水解显碱性,则c(OH-)>c(H+),溶液中电荷守恒为:2c(CO32-)+c(HCO3-)+c(OH-)=c(Na+)+c(H+),所以2c(CO32-)+c(HCO3-)<c(Na+);
故答案为:<;
(2)①已知:2CO(g)+O2(g)=2CO2 (g)△H=-566.0kJ•mol-1;
O2(g)=2O(g)△H=499kJ•mol-1;
由盖斯定律:两个方程相加除以2即可得到CO(g)+O2(g)?CO2 (g)+O(g)△H=-33.5kJ•mol-1;
故答案为:-33.5;
②某时刻该反应体系中各物质浓度满足:c(CO)•c(O2)=c(CO2)•c(O),则Qc=$\frac{c(C{O}_{2})•c(O)}{c(CO)•c({O}_{2})}$=1>K=04,则反应向左进行;
故答案为:向左;
(3)①2min内O的浓度增大0.6×10-6mol/L,则二氧化碳减小0.6×10-6mol/L,则v(CO2)=$\frac{△c}{t}$=$\frac{6×1{0}^{-7}mol/L}{2min}$=3×10-7mol•L-1•min-1;
故答案为:3×10-7mol•L-1•min-1;
②设生成的氧气为xmol,
2CO2 (g)?2CO(g)+O2(g)
起始量(mol):1 0 0
转化量(mol):2x 2x x
平衡量(mol):1-2x 2x x,
平衡时,氧气的体积分数为0.2,则$\frac{x}{1+x}$=0.2%,则x=0.002,则c(CO2)=0.996mol/L,c(CO)=0.004mol/L,c(O2)=0.002mol/L,
则K=$\frac{0.00{4}^{2}×0.002}{0.99{6}^{2}}$≈3.2×10-8 mol•L-1;
故答案为:3.2×10-8 mol•L-1;
(4)利用电化学还原CO2制取ZnC2O4,则Zn失电子,所以Zn在阳极上失电子生成锌离子,即锌与正极相连;Pb电极上CO2得电子生成C2O42-,则其电极反应为:2CO2+2e-=C2O42-;
故答案为:正;2CO2+2e-=C2O42-.
点评 本题考查了离子浓度大小比较、盖斯定律的计算、反应速率的计算、化学平衡的有关计算、电解原理的应用等,题目综合性较强,题目难度中等,试题侧重于学生的分析能力和计算能力的考查,注意把握有关计算方法以及电解原理.

 科学实验活动册系列答案
科学实验活动册系列答案| A. | 钠与水反应 | B. | FeCl3与NaOH溶液反应 | ||
| C. | Al(OH)3与盐酸反应 | D. | NaHCO3受热分解 |
| A. | c(Cl-)>c(NH4+)>c(OH-)>c(H+) | B. | c(Cl-)>c(NH4+)>c(H+)>c(OH-) | ||
| C. | c(NH4+)>c(Cl-)>c(H+)>c(OH-) | D. | c(H+)>c(Cl-)>c(NH4+)>c(OH-) |
| A. | 3 种 | B. | 4 种 | C. | 5 种 | D. | 6 种 |
 .
.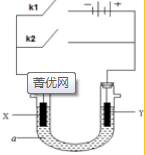 原电池与电解池在化学工业中有广泛应用.如图装置,a为CuCl2溶液,X为Fe棒,Y为碳棒,回答以下问题:
原电池与电解池在化学工业中有广泛应用.如图装置,a为CuCl2溶液,X为Fe棒,Y为碳棒,回答以下问题: Fe2+;电解质溶液中的阳离子向Y极移动(填X或Y);
Fe2+;电解质溶液中的阳离子向Y极移动(填X或Y);
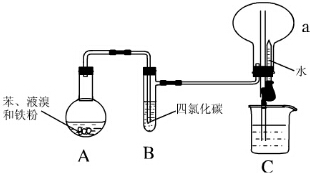 Ⅰ.某同学设计了如图所示的实验装置(夹持装置已略去)来研究苯和溴发生的反应.
Ⅰ.某同学设计了如图所示的实验装置(夹持装置已略去)来研究苯和溴发生的反应.