题目内容
19.室温时,下列混合溶液的pH一定小于7的是( )| A. | pH=3的盐酸和pH=11的氨水等体积混合 | |
| B. | 0.1mol/L的盐酸和0.1mol/L的氢氧化钡溶液等体积混合 | |
| C. | pH=3的醋酸和pH=11的氢氧化钡溶液等体积混合 | |
| D. | pH=3的硫酸和pH=11的氨水等体积混合 |
分析 A.pH=3的盐酸和pH=11的氨水等体积混合,一水合氨为弱电解质存在电离平衡,反应后一水合氨又电离出氢氧根离子溶液显碱性;
B.氢氧化钡为二元碱,盐酸为一元酸,等体积混合氢氧根离子剩余;
C.pH=3的醋酸和pH=11的氢氧化钡溶液等体积混合,次数为弱酸存在电离平衡,混合后醋酸又电离出氢离子,溶液显酸性;
D.pH=3的硫酸和pH=11的氨水等体积混合,一水合氨为弱电解质存在电离平衡,反应后一水合氨又电离出氢氧根离子溶液显碱性;
解答 解:A.pH=3的盐酸和pH=11的氨水等体积混合,一水合氨为弱电解质存在电离平衡,反应后一水合氨又电离出氢氧根离子溶液显碱性,溶液PH>7,故A不符合;
B.氢氧化钡为二元碱,盐酸为一元酸,等体积混合氢氧根离子剩余溶液显碱性,溶液PH>7,故B不符合;
C.pH=3的醋酸和pH=11的氢氧化钡溶液等体积混合,次数为弱酸存在电离平衡,混合后醋酸又电离出氢离子,溶液显酸性,溶液PH<7,故C符合;
D.pH=3的硫酸和pH=11的氨水等体积混合,硫酸是强酸,一水合氨为弱电解质存在电离平衡,反应后一水合氨又电离出氢氧根离子溶液显碱性,溶液PH>7,故D不符合;
故选C.
点评 本题考查了酸碱混合溶液酸碱性的分析判断,主要是弱电解质电离平衡的分析判断,掌握基础是解题关键,题目较简单.

练习册系列答案
相关题目
7.将10mL0.1mol/L的氨水与5mL0.2mol/L盐酸混和后溶液中离子浓度的关系正确的是( )
| A. | c(Cl-)>c(NH4+)>c(OH-)>c(H+) | B. | c(Cl-)>c(NH4+)>c(H+)>c(OH-) | ||
| C. | c(NH4+)>c(Cl-)>c(H+)>c(OH-) | D. | c(H+)>c(Cl-)>c(NH4+)>c(OH-) |
10.某同学在用稀硫酸与锌制取氢气的实验中,发现加入少量硫酸铜溶液可加快氢气的生成速率.请回答下列问题:
(1)上述实验中发生反应的化学方程式有Zn+CuSO4=ZnSO4+Cu,Zn+H2SO4═ZnSO4+H2↑
(2)硫酸铜溶液可以加快氢气生成速率的原因是CuSO4与Zn反应产生的Cu与Zn形成Cu/Zn原电池,加快了氢气产生的速率;
(3)实验室中现有Na2SO4、MgSO4、Ag2SO4、K2SO4等4种溶液,可与上述实验中CuSO4溶液起相似作用的是Ag2SO4;
(4)要加快上述实验中气体产生的速率,还可采取的措施有:升高反应温度、适当增加硫酸的浓度(答两种);
(5)为了进一步研究硫酸铜的量对氢气生成速率的影响,该同学设计了如表一系列实验.将表中所给的混合溶液分别加入到6个盛有过量Zn粒的反应瓶中,收集产生的气体,记录获得相同体积的气体所需时间.
①请完成此实验设计,其中:V1=30,V9=17.5;
②该同学最后得出的结论为:当加入少量CuSO4溶液时,生成氢气的速率会大大提高.但当加入的CuSO4溶液超过一定量时,生成氢气的速率反而会下降.请分析氢气生成速率下降的主要原因:当加入一定量的CuSO4后,生成的单质Cu会沉积在Zn的表面,降低了Zn与溶液的接触面积.
(1)上述实验中发生反应的化学方程式有Zn+CuSO4=ZnSO4+Cu,Zn+H2SO4═ZnSO4+H2↑
(2)硫酸铜溶液可以加快氢气生成速率的原因是CuSO4与Zn反应产生的Cu与Zn形成Cu/Zn原电池,加快了氢气产生的速率;
(3)实验室中现有Na2SO4、MgSO4、Ag2SO4、K2SO4等4种溶液,可与上述实验中CuSO4溶液起相似作用的是Ag2SO4;
(4)要加快上述实验中气体产生的速率,还可采取的措施有:升高反应温度、适当增加硫酸的浓度(答两种);
(5)为了进一步研究硫酸铜的量对氢气生成速率的影响,该同学设计了如表一系列实验.将表中所给的混合溶液分别加入到6个盛有过量Zn粒的反应瓶中,收集产生的气体,记录获得相同体积的气体所需时间.
| 实验 混合溶液 | A | B | C | D | E | F |
| 4mol•L-1 H2SO4/mL | 30 | V1 | V2 | V3 | V4 | V5 |
| 饱和CuSO4溶液/mL | 0 | 0.5 | 2.5 | 5 | V6 | 20 |
| H2O/mL | V7 | V8 | V9 | V10 | 10 | 0 |
②该同学最后得出的结论为:当加入少量CuSO4溶液时,生成氢气的速率会大大提高.但当加入的CuSO4溶液超过一定量时,生成氢气的速率反而会下降.请分析氢气生成速率下降的主要原因:当加入一定量的CuSO4后,生成的单质Cu会沉积在Zn的表面,降低了Zn与溶液的接触面积.
7.分子式为 C4H10O 并能与金属钠反应放出氢气的有机物有(不含立体异构)( )
| A. | 3 种 | B. | 4 种 | C. | 5 种 | D. | 6 种 |
4.有关如图所示原电池(盐桥中装有含琼胶的KCl饱和溶液)的叙述,正确的是( )
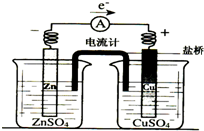

| A. | 铜片上有气泡逸出 | |
| B. | 取出盐桥后,电流计依然发生偏转 | |
| C. | 反应中,盐桥中的K+会移向CuSO4溶液 | |
| D. | 铜片上发生氧化反应 |
11.某无色透明溶液,在pH=0和pH=14的条件下都能大量共存的是( )
| A. | Fe2+、K+、SO42ˉ、NO3ˉ | B. | Mg2+、NH4+、SO42-、Clˉ | ||
| C. | Na+、K+、SO42ˉ、NO3ˉ | D. | Ba2+、Na+、CO32-、NO3ˉ |
8.含有一个双键的烯烃,和氢气加成后的产物结构简式如图,则此烃可能有的结构有( )


| A. | 4 种 | B. | 5 种 | C. | 7 种 | D. | 9 种 |
9.化学在生活中无处不在,下列说法错误的是( )
| A. | 炒菜时加入一些料酒和食醋,这样可使菜变得味香可口,这是因为有酯类物质生成 | |
| B. | 禁止使用工业酒精配制料酒,这是因为工业酒精中常含有少量会使人中毒的甲醇 | |
| C. | 苯酚不小心蘸到皮肤上,应用NaHCO3溶液擦洗 | |
| D. | 夏季蚊虫较多,一旦被叮咬,就会感到皮肤瘙痒,这是由于蚊虫的分泌液中含有甲酸 |