题目内容
16.下列化学用语正确的是( )| A. | (NH4)2Fe(SO4)2溶解于水:(NH4)2Fe(SO4)2?2NH4++Fe2++2SO42- | |
| B. | Al(OH)3在水中的电离:Al(OH)3?Al3++3OH- | |
| C. | H3PO4溶解于水:H3PO4+3H2O?3H3O++PO43- | |
| D. | NaHSO3在水中的电离:HSO3-+H3O+?SO32-+H2O |
分析 A.(NH4)2Fe(SO4)2为强电解质,完全电离;
B.Al(OH)3为多元弱碱,一步电离完成,存在电离平衡;
C.H3PO4为中强酸,存在电离平衡,以第一步电离为主;
D.NaHSO3为强电解质,HSO3-电离大于水解.
解答 解:A.(NH4)2Fe(SO4)2为强电解质,完全电离,则电离方程式为(NH4)2Fe(SO4)2═2NH4++Fe2++2SO42-,故A错误;
B.Al(OH)3为多元弱碱,一步电离完成,存在电离平衡,则电离方程式为Al(OH)3?Al3++3OH-,故B正确;
C.H3PO4为中强酸,存在电离平衡,以第一步电离为主,则电离方程式为H3PO4+H2O?H3O++H2PO4-,故C错误;
D.NaHSO3为强电解质,HSO3-电离大于水解,则在水中的电离为NaHSO3═Na++HSO3-、HSO3-+H2O?SO32-+H3O+,故D错误;
故选B.
点评 本题考查电离方程式的书写,为高频考点,把握电解质的强弱、弱电解质的电离平衡为解答的关键,侧重分析与应用能力的考查,注意多元弱碱一步电离,题目难度不大.

练习册系列答案
相关题目
6.下列属于氧化还原反应的是( )
| A. | 钠与水反应 | B. | FeCl3与NaOH溶液反应 | ||
| C. | Al(OH)3与盐酸反应 | D. | NaHCO3受热分解 |
7.将10mL0.1mol/L的氨水与5mL0.2mol/L盐酸混和后溶液中离子浓度的关系正确的是( )
| A. | c(Cl-)>c(NH4+)>c(OH-)>c(H+) | B. | c(Cl-)>c(NH4+)>c(H+)>c(OH-) | ||
| C. | c(NH4+)>c(Cl-)>c(H+)>c(OH-) | D. | c(H+)>c(Cl-)>c(NH4+)>c(OH-) |
11.中国传统文化对人类文明贡献巨大,我国古代的人民在那时候就已经广泛应用了,书中充分记载了古代化学研究成果.下列关于古代化学的应用和记载,对其说明不合理的是( )
| A. | 《本草纲目》中记载“(火药)乃焰消(KNO3)、硫磺、杉木炭所合,以烽燧铳极”这是利用了“KNO3的氧化性” | |
| B. | 李白有诗云“日照香炉生紫烟”这是描写“碘的升华” | |
| C. | 《本草经集注》中记载了区分硝石(KNO3)和朴消(Na2SO4)的方法:“以火烧之,烟起,乃真硝石也”这是利用了“焰色反应” | |
| D. | 我国古代人民常用明矾除去铜器上的铜锈[Cu2(OH)2CO3] |
3.氧化剂H2O2在反应时不产生污染物被称为绿色氧化剂,因而受到人们越来越多的关注.
I.某实验小组以H2O2分解为例,探究浓度、催化剂、溶液酸碱性对反应速率的影响.在常温下按照如表所示的方案完成实验.
(1)实验①和②的目的是探究浓度对反应速率的影响.
(2)实验③④⑤中,测得生成氧气的体积随时间变化的关系如图1所示.

分析该图能够得出的实验结论是碱性环境能增大H2O2分解的速率,酸性环境能减小H2O2分解的速率.
Ⅱ.资料显示,某些金属离子对H2O2的分解起催化作用.为探究不同浓度的Fe3+对H2O2分解的催化效果,实验小组的同学设计了如图2所示的实验装置进行实验.
限选试剂:30% H2O2、0.1mol?L-1Fe2(SO4)3、蒸馏水
(3)某同学通过测定O2的体积来比较H2O2的分解速率快慢.实验时可以通过测量相同时间内产生O2的体积(产生相同体积氧气所需的时间)来比较.(要求所测得的数据能直接体现反应速率大小).
(4)参照如表格式,拟定实验表格,完整体现上述实验的方案(列出所选试剂体积、需记录的待测物理量和所拟定的数据;数据用字母表示).
I.某实验小组以H2O2分解为例,探究浓度、催化剂、溶液酸碱性对反应速率的影响.在常温下按照如表所示的方案完成实验.
| 实验编号 | 反应物 | 加入物质 |
| ① | 10mL 2% H2O2溶液 | 无 |
| ② | 10mL 5% H2O2溶液 | 无 |
| ③ | 9mL 5% H2O2溶液 | 1mL 水 |
| ④ | 9mL 5% H2O2溶液 | 1mL 0.1mol•L-1 HCl溶液 |
| ⑤ | 9mL 5% H2O2溶液 | 1mL 0.1mol•L-1 NaOH溶液 |
(2)实验③④⑤中,测得生成氧气的体积随时间变化的关系如图1所示.

分析该图能够得出的实验结论是碱性环境能增大H2O2分解的速率,酸性环境能减小H2O2分解的速率.
Ⅱ.资料显示,某些金属离子对H2O2的分解起催化作用.为探究不同浓度的Fe3+对H2O2分解的催化效果,实验小组的同学设计了如图2所示的实验装置进行实验.
限选试剂:30% H2O2、0.1mol?L-1Fe2(SO4)3、蒸馏水
(3)某同学通过测定O2的体积来比较H2O2的分解速率快慢.实验时可以通过测量相同时间内产生O2的体积(产生相同体积氧气所需的时间)来比较.(要求所测得的数据能直接体现反应速率大小).
(4)参照如表格式,拟定实验表格,完整体现上述实验的方案(列出所选试剂体积、需记录的待测物理量和所拟定的数据;数据用字母表示).
| 物理量 实验序号 | V[30% H2O2]/mL | … | |
| 1 | a | … | |
| 2 | a | … |
10.某同学在用稀硫酸与锌制取氢气的实验中,发现加入少量硫酸铜溶液可加快氢气的生成速率.请回答下列问题:
(1)上述实验中发生反应的化学方程式有Zn+CuSO4=ZnSO4+Cu,Zn+H2SO4═ZnSO4+H2↑
(2)硫酸铜溶液可以加快氢气生成速率的原因是CuSO4与Zn反应产生的Cu与Zn形成Cu/Zn原电池,加快了氢气产生的速率;
(3)实验室中现有Na2SO4、MgSO4、Ag2SO4、K2SO4等4种溶液,可与上述实验中CuSO4溶液起相似作用的是Ag2SO4;
(4)要加快上述实验中气体产生的速率,还可采取的措施有:升高反应温度、适当增加硫酸的浓度(答两种);
(5)为了进一步研究硫酸铜的量对氢气生成速率的影响,该同学设计了如表一系列实验.将表中所给的混合溶液分别加入到6个盛有过量Zn粒的反应瓶中,收集产生的气体,记录获得相同体积的气体所需时间.
①请完成此实验设计,其中:V1=30,V9=17.5;
②该同学最后得出的结论为:当加入少量CuSO4溶液时,生成氢气的速率会大大提高.但当加入的CuSO4溶液超过一定量时,生成氢气的速率反而会下降.请分析氢气生成速率下降的主要原因:当加入一定量的CuSO4后,生成的单质Cu会沉积在Zn的表面,降低了Zn与溶液的接触面积.
(1)上述实验中发生反应的化学方程式有Zn+CuSO4=ZnSO4+Cu,Zn+H2SO4═ZnSO4+H2↑
(2)硫酸铜溶液可以加快氢气生成速率的原因是CuSO4与Zn反应产生的Cu与Zn形成Cu/Zn原电池,加快了氢气产生的速率;
(3)实验室中现有Na2SO4、MgSO4、Ag2SO4、K2SO4等4种溶液,可与上述实验中CuSO4溶液起相似作用的是Ag2SO4;
(4)要加快上述实验中气体产生的速率,还可采取的措施有:升高反应温度、适当增加硫酸的浓度(答两种);
(5)为了进一步研究硫酸铜的量对氢气生成速率的影响,该同学设计了如表一系列实验.将表中所给的混合溶液分别加入到6个盛有过量Zn粒的反应瓶中,收集产生的气体,记录获得相同体积的气体所需时间.
| 实验 混合溶液 | A | B | C | D | E | F |
| 4mol•L-1 H2SO4/mL | 30 | V1 | V2 | V3 | V4 | V5 |
| 饱和CuSO4溶液/mL | 0 | 0.5 | 2.5 | 5 | V6 | 20 |
| H2O/mL | V7 | V8 | V9 | V10 | 10 | 0 |
②该同学最后得出的结论为:当加入少量CuSO4溶液时,生成氢气的速率会大大提高.但当加入的CuSO4溶液超过一定量时,生成氢气的速率反而会下降.请分析氢气生成速率下降的主要原因:当加入一定量的CuSO4后,生成的单质Cu会沉积在Zn的表面,降低了Zn与溶液的接触面积.
7.分子式为 C4H10O 并能与金属钠反应放出氢气的有机物有(不含立体异构)( )
| A. | 3 种 | B. | 4 种 | C. | 5 种 | D. | 6 种 |
8.含有一个双键的烯烃,和氢气加成后的产物结构简式如图,则此烃可能有的结构有( )


| A. | 4 种 | B. | 5 种 | C. | 7 种 | D. | 9 种 |
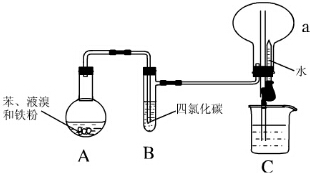 Ⅰ.某同学设计了如图所示的实验装置(夹持装置已略去)来研究苯和溴发生的反应.
Ⅰ.某同学设计了如图所示的实验装置(夹持装置已略去)来研究苯和溴发生的反应.