题目内容
某溶液可能大量含有以下离子:Na+,Ba2+,Fe2+,NO3-,Cl-,离子浓度均为0.1mol/L,加入适量稀硫酸,观察到有气泡产生,溶液颜色发生变化但无沉淀析出,求该溶液一定大量存在的离子.
考点:离子共存问题
专题:离子反应专题
分析:加入适量稀硫酸,观察到有气泡产生,溶液颜色发生变化但无沉淀析出,则一定不含Ba2+,发生氧化还原反应生成NO气体,一定含Fe2+、NO3-,结合电荷守恒分析.
解答:
解:加入适量稀硫酸,观察到有气泡产生,溶液颜色发生变化但无沉淀析出,则一定不含Ba2+,发生氧化还原反应生成NO气体,一定含Fe2+、NO3-,离子浓度均为0.1mol/L,由电荷守恒可知,一定含阴离子Cl-,而不含Na+,
答:该溶液一定大量存在的离子为Fe2+、NO3-、Cl-.
答:该溶液一定大量存在的离子为Fe2+、NO3-、Cl-.
点评:本题考查离子的共存,为高频考点,把握习题中的信息及离子之间的反应为解答的关键,侧重氧化还原反应及电荷守恒的考查,题目难度不大.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
己知25℃时,Ksp(AgCl)=1.8×10-10,Ksp(AgBr)=5.4×10-13,Ksp(AgI)=8.5×10-17.某溶液中含有Cl-、Br-和I-,浓度均为0.010mol?L-1,向该溶液中逐滴加入0.010mol?L-1的AgNO3溶液时,三种阴离子产生沉淀的先后顺序为( )
| A、Cl-、Br-、I- |
| B、Br-、Cl-、I- |
| C、I-、Br-、Cl- |
| D、Br-、I-、Cl- |
在常温下,PH=a的醋酸和PH=14-a的NaOH溶液等体积混合,所得溶液的下列说法正确的是( )
| A、PH<7 |
| B、PH=7 |
| C、PH>7 |
| D、上述三种均有可能 |
下列说法正确的是( )


| A、已知常温下,物质的量浓度相等的CH3COONa与CH3COOH混合液的pH<7,在此溶液中继续加CH3COONa至pH=7,测得此时c(Na+ )=c(CH3COO-)>c(CH3COOH)>c(H+)=c(OH-) |
| B、0.01 mol?L-1的Na2HPO4溶液中存在如下的平衡:HPO42-+H2O?H2PO4-+OH- HPO42-?H++PO43- 且溶液pH>7;加水稀释后溶液中HPO42-、PO43-、H+的浓度均减小 |
| C、图中,Y轴S表示相应金属氢氧化物在饱和溶液中阳离子的浓度,由图中数据可计算出室温下Ksp[Cu(OH)2]=1.0×10-12 |
| D、由图可知,若Fe(NO3)3溶液中含有少量的Co2+杂质,可通过加入Fe(OH)3的方法来除去 |
 将一定质量的镁铝合金投入200mL一定浓度的盐酸中,合金完全溶解,向所得溶液中滴加浓度为5mol/L的NaOH溶液,生成的沉淀跟加入的NaOH溶液的体积关系如图.(横坐标体积单位是mL,纵坐标质量单位是g)求:
将一定质量的镁铝合金投入200mL一定浓度的盐酸中,合金完全溶解,向所得溶液中滴加浓度为5mol/L的NaOH溶液,生成的沉淀跟加入的NaOH溶液的体积关系如图.(横坐标体积单位是mL,纵坐标质量单位是g)求: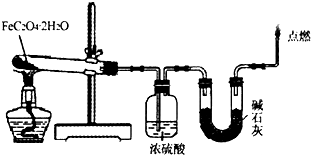 (1)取一定质量H2C2O4?2H2O和KHC2O4的混合物,加水溶解,配成250mL溶液,取两份此溶液各25mL,向第一份溶液中先加入几滴酚酞试液,再滴加0.25mol?L-1 NaOH溶液至20.00mL时,溶液由无色变为浅红色;向第二份溶液中滴加适量3mol?L-1H2SO4溶液酸化后,用0.10mol?L-1KMnO4溶液滴定,消耗KMnO4溶液16.00mL时达到终点.请回答下列问题
(1)取一定质量H2C2O4?2H2O和KHC2O4的混合物,加水溶解,配成250mL溶液,取两份此溶液各25mL,向第一份溶液中先加入几滴酚酞试液,再滴加0.25mol?L-1 NaOH溶液至20.00mL时,溶液由无色变为浅红色;向第二份溶液中滴加适量3mol?L-1H2SO4溶液酸化后,用0.10mol?L-1KMnO4溶液滴定,消耗KMnO4溶液16.00mL时达到终点.请回答下列问题