题目内容
下列说法正确的是( )


| A、已知常温下,物质的量浓度相等的CH3COONa与CH3COOH混合液的pH<7,在此溶液中继续加CH3COONa至pH=7,测得此时c(Na+ )=c(CH3COO-)>c(CH3COOH)>c(H+)=c(OH-) |
| B、0.01 mol?L-1的Na2HPO4溶液中存在如下的平衡:HPO42-+H2O?H2PO4-+OH- HPO42-?H++PO43- 且溶液pH>7;加水稀释后溶液中HPO42-、PO43-、H+的浓度均减小 |
| C、图中,Y轴S表示相应金属氢氧化物在饱和溶液中阳离子的浓度,由图中数据可计算出室温下Ksp[Cu(OH)2]=1.0×10-12 |
| D、由图可知,若Fe(NO3)3溶液中含有少量的Co2+杂质,可通过加入Fe(OH)3的方法来除去 |
考点:盐类水解的原理,难溶电解质的溶解平衡及沉淀转化的本质
专题:电离平衡与溶液的pH专题,盐类的水解专题
分析:A.常温下,混合液的pH=7,溶液显示中性,则c(H+)=c(OH-),根据电荷守恒判断溶液中各离子浓度大小;
B.0.01 mol?L-1的Na2HPO4溶液pH>7,则HPO42-的水解程度大于其电离程度,溶液显示碱性,稀释后溶液碱性减小,而水的离子积不变,据此判断氢离子浓度变化;
C.当pH=5时,即氢氧根浓度为10-9,溶液的铜离子浓度是0.01;
D.氢氧化铁的溶度积小.
B.0.01 mol?L-1的Na2HPO4溶液pH>7,则HPO42-的水解程度大于其电离程度,溶液显示碱性,稀释后溶液碱性减小,而水的离子积不变,据此判断氢离子浓度变化;
C.当pH=5时,即氢氧根浓度为10-9,溶液的铜离子浓度是0.01;
D.氢氧化铁的溶度积小.
解答:
解:A.常温下,混合液的pH=7,则c(H+)=c(OH-),根据电荷守恒可知:c(Na+)=c(CH3COO-),且溶液中c(CH3COOH)较小,则溶液中各离子浓度大小为:c(Na+)=c(CH3COO-)>c(CH3COOH)>c(H+)=c(OH-),故A正确;
B.0.01 mol?L-1的Na2HPO4溶液的pH>7,溶液显示碱性,则HPO42-的水解程度大于其电离程度,稀释后溶液中氢氧根离子浓度减小,而温度不变,则水的离子积不变,所以溶液中氢离子浓度会增大,故B错误;
C.当pH=5时,即氢氧根浓度为10-9,溶液的铜离子浓度是0.01,所以Ksp=0.01×10-18=1×10-20,故C错误;
D.沉淀向更难溶的方向转化,氢氧化铁的溶度积小,不能使Co2+转化为沉淀,故D错误.
故选A.
B.0.01 mol?L-1的Na2HPO4溶液的pH>7,溶液显示碱性,则HPO42-的水解程度大于其电离程度,稀释后溶液中氢氧根离子浓度减小,而温度不变,则水的离子积不变,所以溶液中氢离子浓度会增大,故B错误;
C.当pH=5时,即氢氧根浓度为10-9,溶液的铜离子浓度是0.01,所以Ksp=0.01×10-18=1×10-20,故C错误;
D.沉淀向更难溶的方向转化,氢氧化铁的溶度积小,不能使Co2+转化为沉淀,故D错误.
故选A.
点评:本题考查了离子浓度大小比较、盐的水解原理及其应用,题目难度较大,注意掌握比较溶液中离子浓度大小的方法,明确电荷守恒、物料守恒、盐的水解原理的应用方法,试题培养了学生的分析、理解能力及灵活应用所学知识的能力.

练习册系列答案
 阶梯计算系列答案
阶梯计算系列答案
相关题目
如图:X为铁棒,Y为铜棒,b为电解液.当K闭合后,下列有关分析不正确的是( )


| A、当a为电流表,b为浓硝酸时:Y为负极 |
| B、当a为电流表,b为稀硫酸时:X电极反应为:Fe-2e-=Fe2+ |
| C、当a为直流电源,b为CuSO4溶液时:X、Y两电极附近的 SO42-浓度相等 |
| D、当a为直流电源,b为NaOH溶液,X极附近产生白色沉淀时:电子从X极流出 |
已知常温下BaSO4的溶解度为2.33×10-4g,类似于水的离子积,难溶盐AmBn也有离子积Ksp且Ksp=〔C(An+)〕m?〔C(Bm-)〕n,则BaSO4的Ksp约为( )
| A、2.33×10-4 |
| B、1×10-5 |
| C、1×10-10 |
| D、1×10-12 |
一定温度下,在一个容积为1L的密闭容器中,充入1mol H2(g)和1mol I2(g),发生反应H2(g)+I2(g)?2HI(g),经充分反应达到平衡后,生成的HI(g)的气体体积的50%,在该温度下,在另一个容积为2L的密闭容器中充入1mol HI(g)发生反应HI(g)?
H2(g)+
I2(g),则下列判断正确的是( )
| 1 |
| 2 |
| 1 |
| 2 |
| A、后一反应的平衡常数为1 |
| B、后一反应的平衡常数为0.5 |
| C、后一反应达到平衡时,H2的平衡浓度为0.25mol?L-1 |
| D、后一反应达到平衡时,HI(g)的平衡浓度为0.5 mol?L-1 |
反应2A(气)+3B(气)?xC(气)+yD(气),已知起始浓度A为5mol/L,B为3mol/L;C的反应速率为0.5mol/L?min;反应开始至平衡需2min;平衡时D的浓度为0.5mol/L.下列说法不正确的是( )
| A、V(A)平:V(B)平=5:3 |
| B、A的转化率为20% |
| C、x:y=2:1 |
| D、D的反应速率为0.25 mol/(L?min) |
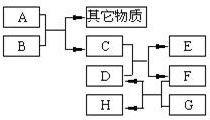 已知B为黑色粉末,用D、E、G作焰色反应,隔蓝色钴玻璃观察,焰色均呈紫色,F为深红棕色液体,H能使淀粉变蓝,它们之间的相互转化关系如图所示.
已知B为黑色粉末,用D、E、G作焰色反应,隔蓝色钴玻璃观察,焰色均呈紫色,F为深红棕色液体,H能使淀粉变蓝,它们之间的相互转化关系如图所示.