题目内容
 (1)取一定质量H2C2O4?2H2O和KHC2O4的混合物,加水溶解,配成250mL溶液,取两份此溶液各25mL,向第一份溶液中先加入几滴酚酞试液,再滴加0.25mol?L-1 NaOH溶液至20.00mL时,溶液由无色变为浅红色;向第二份溶液中滴加适量3mol?L-1H2SO4溶液酸化后,用0.10mol?L-1KMnO4溶液滴定,消耗KMnO4溶液16.00mL时达到终点.请回答下列问题
(1)取一定质量H2C2O4?2H2O和KHC2O4的混合物,加水溶解,配成250mL溶液,取两份此溶液各25mL,向第一份溶液中先加入几滴酚酞试液,再滴加0.25mol?L-1 NaOH溶液至20.00mL时,溶液由无色变为浅红色;向第二份溶液中滴加适量3mol?L-1H2SO4溶液酸化后,用0.10mol?L-1KMnO4溶液滴定,消耗KMnO4溶液16.00mL时达到终点.请回答下列问题①第二份溶液中滴定终点的判断现象是:
②第二份溶液中生成的H2C2O4在酸性条件下与KMnO4溶液反应的离子方程式:
③混合物中H2C2O4?2H2O和KHC2O4的物质的量之比为
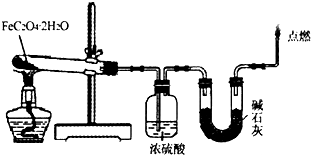
(2)某实验小组用如图所示的装置探究FeC2O4?2H2O在隔绝空气条件下受热分解的产物.当36.0g FeC2O4?2H2O充分反应后,残留固体质量为13.6g,浓硫酸增重7.2g,碱石灰增重11.0g.求残留固体的成分和物质的量.(已知FeC2O4?2H2O的相对分子质量为180;设反应产生的气体被充分吸收)
考点:探究物质的组成或测量物质的含量
专题:实验探究和数据处理题
分析:(1)①第二份溶液中滴定终点,溶液由无色变为浅红色;
②H2C2O4在酸性条件下与KMnO4溶液反应,生成二氧化碳、Mn2+和水;
③依据原子守恒和化学方程式计算得到;
(2)最后被点燃的为一氧化碳气体,浓硫酸增重7.2g为水,碱石灰增重11.0g为二氧化碳气体,依据反应生成的物质在过程中的质量分别计算得到.
②H2C2O4在酸性条件下与KMnO4溶液反应,生成二氧化碳、Mn2+和水;
③依据原子守恒和化学方程式计算得到;
(2)最后被点燃的为一氧化碳气体,浓硫酸增重7.2g为水,碱石灰增重11.0g为二氧化碳气体,依据反应生成的物质在过程中的质量分别计算得到.
解答:
解:(1)①第二份溶液中滴定终点,溶液由无色变为浅红色,且30s内不褪色,故答案为:溶液由无色变为浅紫红色.且30s内不褪色;
②H2C2O4在酸性条件下与KMnO4溶液反应,生成二氧化碳、Mn2+和水,反应的离子方程式为5C2O42-+2Mn04-+16H+═10CO2+2Mn2++8H2O,
故答案为:5C2O42-+2Mn04-+16H+═10CO2+2Mn2++8H2O;
③25mL中,设xmol H2C2O4?2H2O ymol KHC2O4根据滴定的,可以得出:2x+y=0.25×0.02,
根据氧化还原的,可以得出:x+y=0.1×0.016×2.5,x=0.001,y=0.003mol,所以原混合物中H2C2O4?2H2O和KHC2O4的物质的量之比为1:3,
故答案为:1:3;
(2)被点燃的气体为CO,质量为m(CO)=36.0 g-13.6 g-7.2 g-11.0 g=4.2 g;
又FeC2O4?2H2O为0.2 mol,n(H2O)=7.2 g÷18 g/mol=0.4 mol,
n(CO2)=11.0 g÷44 g/mol=0.25 mol,n(CO)=4.2 g÷28 g/mol=0.15 mol,
所以,残留固体中所含元素及物质的量为n(Fe)=0.2 mol,n(O)=0.15 mol,
则残留固体为Fe和FeO的混合物,其中Fe为0.05 mol,FeO为0.15 mol;
答:Fe为0.05 mol,FeO为0.15 mol.
②H2C2O4在酸性条件下与KMnO4溶液反应,生成二氧化碳、Mn2+和水,反应的离子方程式为5C2O42-+2Mn04-+16H+═10CO2+2Mn2++8H2O,
故答案为:5C2O42-+2Mn04-+16H+═10CO2+2Mn2++8H2O;
③25mL中,设xmol H2C2O4?2H2O ymol KHC2O4根据滴定的,可以得出:2x+y=0.25×0.02,
根据氧化还原的,可以得出:x+y=0.1×0.016×2.5,x=0.001,y=0.003mol,所以原混合物中H2C2O4?2H2O和KHC2O4的物质的量之比为1:3,
故答案为:1:3;
(2)被点燃的气体为CO,质量为m(CO)=36.0 g-13.6 g-7.2 g-11.0 g=4.2 g;
又FeC2O4?2H2O为0.2 mol,n(H2O)=7.2 g÷18 g/mol=0.4 mol,
n(CO2)=11.0 g÷44 g/mol=0.25 mol,n(CO)=4.2 g÷28 g/mol=0.15 mol,
所以,残留固体中所含元素及物质的量为n(Fe)=0.2 mol,n(O)=0.15 mol,
则残留固体为Fe和FeO的混合物,其中Fe为0.05 mol,FeO为0.15 mol;
答:Fe为0.05 mol,FeO为0.15 mol.
点评:本题考查物质的含量测定,侧重于学生的分析能力、实验能力和计算能力的考查,注意把握物质的性质,结合反应的方程式计算该题,难度中等.

练习册系列答案
相关题目
反应2A(气)+3B(气)?xC(气)+yD(气),已知起始浓度A为5mol/L,B为3mol/L;C的反应速率为0.5mol/L?min;反应开始至平衡需2min;平衡时D的浓度为0.5mol/L.下列说法不正确的是( )
| A、V(A)平:V(B)平=5:3 |
| B、A的转化率为20% |
| C、x:y=2:1 |
| D、D的反应速率为0.25 mol/(L?min) |
满足通式CnH2nO的有机物甲,既可被氧化为一元羧酸乙,又可被还原为一元醇丙,乙和丙在一定条件下反应生成酯丁,则下列说法正确的是( )
| A、甲和丁的最简式相同 |
| B、丁的分子量是丙的两倍 |
| C、甲既可是饱和一元醛,又可是饱和一元酮 |
| D、甲的分子中一定具有甲基 |
 A、B、C是短周期非金属元素,核电荷数依次增大.A原子外围电子排布为ns2np2,C是地壳中含量最多的元素.D、E是第四周期元素,其中E元素的核电荷数为29.D原子核外未成对电子数在同周期中最多.请用对应的元素符号或化学式填空:
A、B、C是短周期非金属元素,核电荷数依次增大.A原子外围电子排布为ns2np2,C是地壳中含量最多的元素.D、E是第四周期元素,其中E元素的核电荷数为29.D原子核外未成对电子数在同周期中最多.请用对应的元素符号或化学式填空: