题目内容
14.将0.1mol两种气态烃(其中一种为炔烃)组成的混合气体完全燃烧后得3.36L(标况)CO2和3.6g H2O.则这两种烃的物质的量之比说法正确的是( )| A. | 1:1 | B. | 1:2 | C. | 1:3 | D. | 无法计算 |
分析 标况下3.36L二氧化碳的物质的量为:n(CO2)=$\frac{3.36L}{22.4L/mol}$=0.15mol,3.6g水的物质的量为:n(H2O)=$\frac{3.6g}{18g/mol}$=0.2mol,则混合的平均化学式为,C1.5H4,由于是混合物,则肯定含有C原子数小于1.5的烃,即一定含有甲烷,因甲烷中含有4个氢原子,则另一种烃也含有4个氢原子,且为炔烃,则应为丙炔,结合C、H原子的关系计算物质的量之比,以此解答该题.
解答 解:标况下3.36L二氧化碳的物质的量为:n(CO2)=$\frac{3.36L}{22.4L/mol}$=0.15mol,3.6g水的物质的量为:n(H2O)=$\frac{3.6g}{18g/mol}$=0.2mol,则混合的平均化学式为,C1.5H4,由于是混合物,则肯定含有C原子数小于1.5的烃,即一定含有甲烷,因甲烷中含有4个氢原子,则另一种烃也含有4个氢原子,且为炔烃,则应为丙炔,
设含有xmolCH4、ymolC3H4,
则$\left\{\begin{array}{l}{x+y=0.1}\\{x+3y=0.15}\end{array}\right.$,x=0.75,y=0.25,则这两种烃的物质的量之比1:3或3:1.
故选C.
点评 本题考查了有机物分子式的计算,为高频考点,侧重考查学生的分析能力和计算能力,题目难度中等,注意掌握利用平均分子组成判断烃的组成的方法.

练习册系列答案
 智趣寒假作业云南科技出版社系列答案
智趣寒假作业云南科技出版社系列答案
相关题目
12.下列电离方程式错误的是( )
| A. | HCl→H++Cl- | B. | H2CO3?2H++CO32- | ||
| C. | NaCl→Na++Cl- | D. | NH3•H2O?NH4++OH- |
5.乙醇是重要的化工原料,下列说法正确的有( )
| A. | 乙醇催化氧化可制备乙醛 | B. | 乙醇与H2反应可制备乙烷 | ||
| C. | 乙醇与金属钠反应可制备乙醇钠 | D. | 乙醇与乙酸反应可制备乙酸乙酯 |
2.有一种活跃在中学化学题中的物质叫氢化铵(NH5).有人认为它的结构与氯化铵相似,所有的原子最外层都符合相应稀有气体原子的最外层电子层结构,与水反应有气体生成.事实上,目前为止尚未有人能够成功制取氢化铵,所以此物质是否存在仍有争议.但想法还是要有的,万一发现了呢?假设它真的存在,上述观点也正确,则下列有关说法正确的是( )
| A. | NH5中N元素的化合价是+5价 | |
| B. | 1molNH5中含有5NA个N-H键 | |
| C. | NH5的电子式为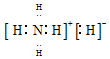 | |
| D. | NH5只由两种非金属元素组成,所以它是共价化合物 |
9.能说明非金属性Cl>S的是( )
①达到稳定结构时,氯原子只需要1个电子,而硫原子需要2个电子
②氯的含氧酸比硫的含氧酸的酸性强③还原性S2->Cl-
④稳定性HCl>H2S⑤酸性HCl>H2S⑥H2S+Cl2=S↓+2HCl
⑦Cl2与H2在光照或点燃下反应,而硫与H2加热下才反应.
①达到稳定结构时,氯原子只需要1个电子,而硫原子需要2个电子
②氯的含氧酸比硫的含氧酸的酸性强③还原性S2->Cl-
④稳定性HCl>H2S⑤酸性HCl>H2S⑥H2S+Cl2=S↓+2HCl
⑦Cl2与H2在光照或点燃下反应,而硫与H2加热下才反应.
| A. | ②③④⑥ | B. | ③④⑥⑦ | C. | ③④⑤⑥ | D. | 全部 |
19.下列表示物质或微粒的化学用语或模型正确的是( )
| A. | 氮分子的结构式:N-N | B. | H2O2的电子式: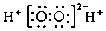 | ||
| C. | 14C的原子结构示意图: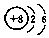 | D. | 钙离子的电子式:Ca2+ |
6.下列实验操作、现象和结论均正确的是( )
| 选项 | 实验操作 | 实验现象 | 结论 |
| A | 向硝酸银溶液中滴加过量氨水 | 溶液澄清 | Ag+与NH3•H2O能大量共存 |
| B | 向某溶液中滴加CCl4,振荡静置 | 下层溶液显紫色 | 原溶液中含有I- |
| C | 向25mL沸水中分别滴入5~6滴FeCl3饱和溶液,继续煮沸至出现红褐色沉淀,用激光笔照射 | 形成一条光亮通路 | 制得Fe(OH)3胶体 |
| D | 向含有酚酞的Na2CO3溶液中加入少量BaCl2固体 | 溶液颜色变浅 | Na2CO3溶液中存在水解平衡 |
| A. | A | B. | B | C. | C | D. | D |
3.原子序数依次递增的四种短周期元素可形成简单离子X2-、Y+、Z3+、M2-,下列说法错误的是( )
| A. | 工业上常采用电解法冶炼Z单质 | |
| B. | 气态氢化物的稳定性:H2X>H2M | |
| C. | 离子半径由大到小:M2->Y+>Z3+>X2- | |
| D. | X、Y形成的化合物中阳离子、阴离子个数比一定是2:1 |
4.下列离子方程式正确的是( )
| A. | 碳酸氢铵溶液与足量氢氧化钠溶液混合后加热:NH4++OH-$\frac{\underline{\;\;△\;\;}}{\;}$NH3↑+H2O | |
| B. | 将少量氯化铁溶液滴入硫化钠溶液中:2Fe3++S2-═2Fe2++S↓ | |
| C. | 向Fe(NO3) 2稀溶液中加入盐酸:3Fe2++4H++NO3-═3Fe3++2H2O+NO↑ | |
| D. | 次氯酸钙溶液中通入过量二氧化碳:Ca2++2ClO-+H2O+CO2═CaCO3↓+2HClO |