题目内容
6.下列实验操作、现象和结论均正确的是( )| 选项 | 实验操作 | 实验现象 | 结论 |
| A | 向硝酸银溶液中滴加过量氨水 | 溶液澄清 | Ag+与NH3•H2O能大量共存 |
| B | 向某溶液中滴加CCl4,振荡静置 | 下层溶液显紫色 | 原溶液中含有I- |
| C | 向25mL沸水中分别滴入5~6滴FeCl3饱和溶液,继续煮沸至出现红褐色沉淀,用激光笔照射 | 形成一条光亮通路 | 制得Fe(OH)3胶体 |
| D | 向含有酚酞的Na2CO3溶液中加入少量BaCl2固体 | 溶液颜色变浅 | Na2CO3溶液中存在水解平衡 |
| A. | A | B. | B | C. | C | D. | D |
分析 A.向硝酸银溶液中滴加过量氨水,生成银氨溶液;
B.碘单质易溶于四氯化碳,为紫色;
C.红褐色沉淀,不是胶体分散系;
D.碳酸钠溶液水解显碱性,加氯化钡反应生成碳酸钡沉淀,水解平衡逆向移动.
解答 解:A.向硝酸银溶液中滴加过量氨水,生成银氨溶液,Ag+与NH3•H2O不能共存,故A错误;
B.碘单质易溶于四氯化碳,为紫色,可知原溶液中含有碘单质,故B错误;
C.红褐色沉淀,不是胶体分散系,出现红褐色液体时为胶体,故C错误;
D.碳酸钠溶液水解显碱性,加氯化钡反应生成碳酸钡沉淀,水解平衡逆向移动,则由现象可知Na2CO3溶液中存在水解平衡,故D正确;
故选D.
点评 本题考查化学实验方案的评价,为高频考点,把握物质的性质、胶体制备、盐类水解为解答的关键,侧重分析与实验能力的考查,注意实验的评价性分析,题目难度不大.

练习册系列答案
相关题目
4.下列物质转化常通过加成反应实现的是( )
| A. |  | B. | CH3CH2OH→CH3CHO | ||
| C. | CH4→CH3Cl | D. | CH2=CH2→CH3CH2Br |
17. 一定温度下,向容积为2L的密闭容器中通入两种气体发生化学反应,反应中各物质的物质的量变化如图所示,对该反应的推断合理的是( )
一定温度下,向容积为2L的密闭容器中通入两种气体发生化学反应,反应中各物质的物质的量变化如图所示,对该反应的推断合理的是( )
 一定温度下,向容积为2L的密闭容器中通入两种气体发生化学反应,反应中各物质的物质的量变化如图所示,对该反应的推断合理的是( )
一定温度下,向容积为2L的密闭容器中通入两种气体发生化学反应,反应中各物质的物质的量变化如图所示,对该反应的推断合理的是( )| A. | 该反应的化学方程式为6A+2D?3B+4C | |
| B. | 反应进行到1s时,v(A)=v(B) | |
| C. | 反应进行到5s时,v(A)=v(B)=v(C)=v(D) | |
| D. | 反应进行到5s时,B的平均反应速率为0.06mol/(L•s) |
14.将0.1mol两种气态烃(其中一种为炔烃)组成的混合气体完全燃烧后得3.36L(标况)CO2和3.6g H2O.则这两种烃的物质的量之比说法正确的是( )
| A. | 1:1 | B. | 1:2 | C. | 1:3 | D. | 无法计算 |
1.水溶液中能大量共存的一组离子是( )
| A. | K+、Ca2+、OH-、HCO3- | B. | Fe2+、H+、CO32-、Cl- | ||
| C. | Mg2+、NH4+、Cl-、SO42- | D. | K+、Fe3+、NO3-、SCN- |
18. 现代煤化工产生的H2S是一种重要的工业资源.请回答:
现代煤化工产生的H2S是一种重要的工业资源.请回答:
(1)用过量的NaOH吸收H2S,请写出该反应的离子方程式:H2S+2OH-=S 2-+2H2O.硫化钠又称臭碱,其溶液盛装在带橡胶塞的试剂瓶中,请用离子方程式解释其溶液呈碱性的原因为:S 2-+H2O?HS-+OH-.己知:25℃时,H2S的Ka1=1×10-7,Ka2=1×10-12,计算此温度时1mol/LNa2S溶液的pH=12.(结果取整数)
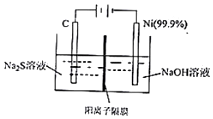
(2)用电解法处理Na2S溶液是处理硫化氢废气的一个重要环节.实验装置如图:
已知阳极的反应为xS2--2(x-1)e-=Sx2-,则阴极的电极反应式是2H++2e-=H2↑或2H2O+2e-=2OH-+H2↑,当反应转移nmole-时,产生标准状况下的气休体积为11.2 n L.
(3)H2S是煤化工原料气脱硫过程的重要中间体.反应原理为:
①COS(g)+H2(g)?H2S(g)+CO(g)△H=+7KJ/mol
②CO(g)+H2O(g)?CO2(g)+H2(g)△H=-42KJ/mol
已知断裂1mol气态分子中的化学键所需能量如表所示.
计算表中x=1074.
(4)向2L容积不变的密闭容器中充入2molCOS(g),2molH2(g)和2molH2O(g),进行(3)中所述两个反应,其他条件不变,随着温度升高,CO的平衡体积分数增大,解释其原因为反应①吸热反应,升高温度,平衡正向动,CO的平衡体积分数增大,反应②是放热反应,升温平衡逆向进行,一氧化碳的平衡体积分数也增大.平衡体系中COS的物质的量为1.6mol时,CO的体积分数为5%,则H2O的平衡转化率为5%,反应②的平衡常数为0.30(保留两位有效数字).
 现代煤化工产生的H2S是一种重要的工业资源.请回答:
现代煤化工产生的H2S是一种重要的工业资源.请回答:(1)用过量的NaOH吸收H2S,请写出该反应的离子方程式:H2S+2OH-=S 2-+2H2O.硫化钠又称臭碱,其溶液盛装在带橡胶塞的试剂瓶中,请用离子方程式解释其溶液呈碱性的原因为:S 2-+H2O?HS-+OH-.己知:25℃时,H2S的Ka1=1×10-7,Ka2=1×10-12,计算此温度时1mol/LNa2S溶液的pH=12.(结果取整数)
(2)用电解法处理Na2S溶液是处理硫化氢废气的一个重要环节.实验装置如图:
已知阳极的反应为xS2--2(x-1)e-=Sx2-,则阴极的电极反应式是2H++2e-=H2↑或2H2O+2e-=2OH-+H2↑,当反应转移nmole-时,产生标准状况下的气休体积为11.2 n L.
(3)H2S是煤化工原料气脱硫过程的重要中间体.反应原理为:
①COS(g)+H2(g)?H2S(g)+CO(g)△H=+7KJ/mol
②CO(g)+H2O(g)?CO2(g)+H2(g)△H=-42KJ/mol
已知断裂1mol气态分子中的化学键所需能量如表所示.
| 分子 | COS | H2 | H2O | CO | H2S | CO2 |
| 能量/KJ/mol | 1323 | 436 | 926 | X | 678 | 1606 |
(4)向2L容积不变的密闭容器中充入2molCOS(g),2molH2(g)和2molH2O(g),进行(3)中所述两个反应,其他条件不变,随着温度升高,CO的平衡体积分数增大,解释其原因为反应①吸热反应,升高温度,平衡正向动,CO的平衡体积分数增大,反应②是放热反应,升温平衡逆向进行,一氧化碳的平衡体积分数也增大.平衡体系中COS的物质的量为1.6mol时,CO的体积分数为5%,则H2O的平衡转化率为5%,反应②的平衡常数为0.30(保留两位有效数字).
15.某电池总反应为 2Fe3++Cu═2Fe2++Cu2+,不能实现该反应的原电池是( )
| A. | 电极材料 Fe、Cu,电解质溶液 FeCl3 溶液 | |
| B. | 电极材料石墨、Cu,电解质溶液 Fe2(SO4)3溶液 | |
| C. | 电极材料 Pt、Cu,电解质溶液 FeCl3溶液 | |
| D. | 电极材料 Ag、Cu,电解质溶液 Fe2(SO4)3溶液 |