题目内容
2.有一种活跃在中学化学题中的物质叫氢化铵(NH5).有人认为它的结构与氯化铵相似,所有的原子最外层都符合相应稀有气体原子的最外层电子层结构,与水反应有气体生成.事实上,目前为止尚未有人能够成功制取氢化铵,所以此物质是否存在仍有争议.但想法还是要有的,万一发现了呢?假设它真的存在,上述观点也正确,则下列有关说法正确的是( )| A. | NH5中N元素的化合价是+5价 | |
| B. | 1molNH5中含有5NA个N-H键 | |
| C. | NH5的电子式为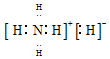 | |
| D. | NH5只由两种非金属元素组成,所以它是共价化合物 |
分析 A、NH5是离子化合物,N元素的化合价是-3价;
B、1molNH5中含1mol的铵根离子;
C、NH5是离子化合物,电子式为: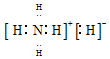 ;
;
D、NH5只由氮和氢两种非金属元素组成,它中含有铵根离子和氢负离子形成的离子键.
解答 解:A、NH5是离子化合物,N元素的化合价是-3价,而不是+5价,故A错误;
B、1molNH5中含1mol的铵根离子,所以有4NA个N-H键,故B错误;
C、有铵根离子和氢负离子形成的离子键,则NH5是离子化合物,电子式为: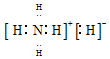 ,故C正确;
,故C正确;
D、NH5只由氮和氢两种非金属元素组成,它中含有铵根离子和氢负离子形成的离子键,是离子化合物,故D错误;
故选C.
点评 本题考查了化学键和电子式,难度较大,能根据题意判断化合物NH5含有的离子是解本题的关键.

练习册系列答案
 名校联盟快乐课堂系列答案
名校联盟快乐课堂系列答案
相关题目
20.将等体积、等物质的量浓度的 NaClO 与 NaOH 溶液混合,下列离子浓度关系正确的是( )
| A. | c(ClO-)=c(OH-) | B. | c(ClO-)+c(OH-)═c(Na+) | ||
| C. | c(OH-)═c(HClO)+c(H+) | D. | 2c(ClO-)+2c(HClO)═c(Na+) |
10.下列反应的离子方程式正确的是( )
| A. | 氧化铜跟硝酸反应:CuO+2H+═Cu2++H2O | |
| B. | NO2气体与水反应:2NO2+H2O═2H++NO3-+NO↑ | |
| C. | 硫酸和氢氧化钡溶液反应:SO42-+H++OH-+Ba2+═BaSO4↓+H2O | |
| D. | AlCl3溶液中加入氨水:Al3++3OH-═Al(OH)3↓ |
17. 一定温度下,向容积为2L的密闭容器中通入两种气体发生化学反应,反应中各物质的物质的量变化如图所示,对该反应的推断合理的是( )
一定温度下,向容积为2L的密闭容器中通入两种气体发生化学反应,反应中各物质的物质的量变化如图所示,对该反应的推断合理的是( )
 一定温度下,向容积为2L的密闭容器中通入两种气体发生化学反应,反应中各物质的物质的量变化如图所示,对该反应的推断合理的是( )
一定温度下,向容积为2L的密闭容器中通入两种气体发生化学反应,反应中各物质的物质的量变化如图所示,对该反应的推断合理的是( )| A. | 该反应的化学方程式为6A+2D?3B+4C | |
| B. | 反应进行到1s时,v(A)=v(B) | |
| C. | 反应进行到5s时,v(A)=v(B)=v(C)=v(D) | |
| D. | 反应进行到5s时,B的平均反应速率为0.06mol/(L•s) |
7.关于目前常用元素周期表的说法中正确的是( )
| A. | 只有第3列到第12列全部是金属元素 | |
| B. | 元素周期表共有7个周期,16个族 | |
| C. | 周期数大于或等于族的序数时,一定是金属元素 | |
| D. | 是按原子的质量数由小到大的顺序编制的 |
14.将0.1mol两种气态烃(其中一种为炔烃)组成的混合气体完全燃烧后得3.36L(标况)CO2和3.6g H2O.则这两种烃的物质的量之比说法正确的是( )
| A. | 1:1 | B. | 1:2 | C. | 1:3 | D. | 无法计算 |
12.己烯雌酚是一种激素类药物,结构如图所示,下列有关叙述不正确的是( )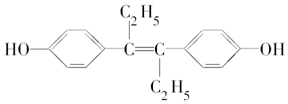

| A. | 可以使溴水褪色 | |
| B. | 该物质能发生氧化反应 | |
| C. | 1 mol该有机物可以与5 mol Br2发生反应 | |
| D. | 可与NaOH和NaHCO3溶液发生反应 |