题目内容
19.下列表示物质或微粒的化学用语或模型正确的是( )| A. | 氮分子的结构式:N-N | B. | H2O2的电子式: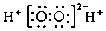 | ||
| C. | 14C的原子结构示意图: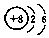 | D. | 钙离子的电子式:Ca2+ |
分析 A.氮原子最外层有5个电子,形成三对共用电子对,达8电子稳定结构;
B.H2O2中两个氢原子分别与两个氧原子通过共用一对电子结合,两个氧原子之间通过共用1对电子结合;
C.14C指质量数为14,核内有6个质子,核外,6个电子,有2个电子层,最外层上有4个电子;
D.简单阳离子电子式为离子符号.
解答 解:A.氮原子最外层有5个电子,形成三对共用电子对,达8电子稳定结构,氮分子的电子式为 ,所以结构式为N≡N,故A错误;
,所以结构式为N≡N,故A错误;
B.H2O2为共价化合物,分子中存在两个氧氢键和一个O-O键,双氧水的电子式为: ,故B错误;
,故B错误;
C.14C的核内有6个质子,核外有2个电子层,第一层上有2个电子、最外层上有4个电子,其原子结构示意图为 ,故C错误;
,故C错误;
D.阳离子电子式为离子符号,钙离子的电子式是Ca2+,故D正确;
故选D.
点评 本题考查化学用语,题目难度不大,易错选项是A,注意氮气分子电子式中三对共用电子对,为易错点.

练习册系列答案
相关题目
17.蛋白质是人类必须的营养物质,下列食品中富含蛋白质的是( )
| A. | 面包 | B. | 米饭 | C. | 牛肉 | D. | 蔬菜 |
10.下列反应的离子方程式正确的是( )
| A. | 氧化铜跟硝酸反应:CuO+2H+═Cu2++H2O | |
| B. | NO2气体与水反应:2NO2+H2O═2H++NO3-+NO↑ | |
| C. | 硫酸和氢氧化钡溶液反应:SO42-+H++OH-+Ba2+═BaSO4↓+H2O | |
| D. | AlCl3溶液中加入氨水:Al3++3OH-═Al(OH)3↓ |
7.关于目前常用元素周期表的说法中正确的是( )
| A. | 只有第3列到第12列全部是金属元素 | |
| B. | 元素周期表共有7个周期,16个族 | |
| C. | 周期数大于或等于族的序数时,一定是金属元素 | |
| D. | 是按原子的质量数由小到大的顺序编制的 |
14.将0.1mol两种气态烃(其中一种为炔烃)组成的混合气体完全燃烧后得3.36L(标况)CO2和3.6g H2O.则这两种烃的物质的量之比说法正确的是( )
| A. | 1:1 | B. | 1:2 | C. | 1:3 | D. | 无法计算 |
4.设NA为阿伏加德罗常数的数值,下列说法正确的是( )
| A. | 过氧化钠与二氧化碳反应时,生成0.1mol氧气转移的电子数为0.4NA | |
| B. | 标准状况下,22.4LH2O含有2NA个共价键 | |
| C. | 常温下,23g NO2含有NA个氧原子 | |
| D. | 1mol ${\;}_{8}^{18}$O2的中子数是20 NA |
8.短周期主族元素X、Y、Z、W的原子序数依次增大,X的最高正价与最低负价的代数和为2,Y是地壳中含量最多的元素,Z原子的最外层电子数是Y原子的最外层电子数的一半,W与Y同主族.下列说法正确的是( )
| A. | 原子半径:r(X)<r(Y)<r(Z)<r(W) | |
| B. | 电解由Y、Z组成的化合物可获得Z的单质 | |
| C. | W的简单气态氢化物的热稳定性比Y的强 | |
| D. | 由X、Y组成的化合物只有两种 |
9.同主族常见的三种元素 X、Y、Z,它们最高价氧化物对应水化物的酸性强弱顺序为:HXO4<HYO4<HZO4,下列判断不正确的是( )
| A. | Y 单质可以在海水中提取 | B. | 单质氧化性:Y>Z | ||
| C. | 气态氢化物稳定性:HX<HZ | D. | 离子半径:X->Y- |