题目内容
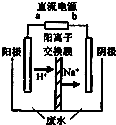
某含铬的污水可用如图所示装置处理,该装置可将污水中的Cr2O72-还原为Cr3+.

(1)图中左右两个装置中, (填“左”或“右”)装置为电解池.电源中负极的活性物质为 (填化学式);电源中两电极间,带负电荷的离子运动的方向为 (填“从左至右”或“从右到左”),该离子为 (填化学式).
(2)请写出阳极上的电极反应式及Cr2O72-被还原为Cr3+的离子方程式分别是: 、 .
(3)为保证正常工作,图中A物质必须循环使用,其化学式为: .
(4)镧系元素均为稀土元素(常用作电极)位于元素周期表第六周期,该周期元素形成的氢氧化物中碱性最强的为 (填写化学式).铈(Ce)有两种氢氧化物Ce(OH)3和Ce(OH)4,前者对空气比较敏感,请用化学方程式表示其原因 .

(1)图中左右两个装置中,
(2)请写出阳极上的电极反应式及Cr2O72-被还原为Cr3+的离子方程式分别是:
(3)为保证正常工作,图中A物质必须循环使用,其化学式为:
(4)镧系元素均为稀土元素(常用作电极)位于元素周期表第六周期,该周期元素形成的氢氧化物中碱性最强的为
考点:电解原理
专题:电化学专题
分析:(1)有外加电源时为电解池,没外加电源为原电池;甲烷燃料电池中,通甲烷的一端为负极,电解污水,铁在阳极放电;电源中两电极间,带负电荷的CO32-离子运动的方向为从右到左;
(2)阳极是活性电极时,阳极本身失电子,生成阳离子;二价铁离子有还原性,Cr2O72-有强氧化性,二者能发生氧化还原反应,根据电子得失配平;
(3)从图中流程可以发现,电解质为碳酸盐,燃料电池的正极上氧气得到电子和负极发生氧化反应,甲烷失去电子,在碱性条件下生成碳酸根离子,可以判定CO2可以重复使用;
(4)同周期元素从左到右元素的金属性逐渐减弱,非金属性逐渐增强;Ce(OH)3和Ce(OH)4中Ce的化合价分别为+3和+4,空气中含有水蒸气和氧气;
(2)阳极是活性电极时,阳极本身失电子,生成阳离子;二价铁离子有还原性,Cr2O72-有强氧化性,二者能发生氧化还原反应,根据电子得失配平;
(3)从图中流程可以发现,电解质为碳酸盐,燃料电池的正极上氧气得到电子和负极发生氧化反应,甲烷失去电子,在碱性条件下生成碳酸根离子,可以判定CO2可以重复使用;
(4)同周期元素从左到右元素的金属性逐渐减弱,非金属性逐渐增强;Ce(OH)3和Ce(OH)4中Ce的化合价分别为+3和+4,空气中含有水蒸气和氧气;
解答:
解:(1)有外加电源时为电解池,左装置有外加电源属于电解池;没外加电源为原电池,右装置没有外加电源为CH4燃料电池;甲烷燃料电池中,通甲烷的一端为负极,负极发生氧化反应,甲烷失去电子,在碱性条件下生成碳酸根离子,负极反应为:CH4+10OH--8e-=CO32-+7H2O,电源中两电极间,带负电荷的CO32-离子向原电池的负极移动,所以运动的方向为从右到左,
故答案为:左;CH4;从右到左;CO32-;
(2)阳极上的电极铁失去电子:Fe-2e-=Fe2+,二价铁离子有还原性,Cr2O72-有强氧化性,二者能发生氧化还原反应,二价铁离子被氧化成三价铁离子,Cr2O72-被还原为Cr3+,反应方程式为:Cr2O72-+6Fe2++14H+═2Cr3++6Fe3++7H2O,
故答案为:Fe-2e-=Fe2+;6Fe2++Cr2O72-+11H2O=6Fe(OH)3↓+2Cr3++4H+;
(3)制备中利用的原料,在转化过程中又生成的可以循环利用;由转化关系图知,通入氧气的一极为原电池的正极,其电极反应式为O2+4e-+2CO2=2CO32-,同时负极发生氧化反应,甲烷失去电子,在碱性条件下生成碳酸根离子,负极反应为:CH4+10OH--8e-=CO32-+7H2O,即A为CO2,同时可以判定CO2可以循环利用,
故答案为:CO2;
(4)同周期元素从左到右元素的金属性逐渐减弱,CS是元素周期表第六周期第ⅠA族元素,所以元素的金属性最强的是CS,氢氧化物中碱性最强的为CsOH,Ce(OH)3和Ce(OH)4中Ce的化合价分别为+3和+4,Ce(OH)3易被氧气氧化成Ce(OH)4,反应为:4Ce(OH)3+O2+2H2O=4Ce(OH)4,空气中含有水蒸气和氧气,所以Ce(OH)3对空气比较敏感,
故答案为:CsOH;4Ce(OH)3+O2+2H2O=4Ce(OH)4;
故答案为:左;CH4;从右到左;CO32-;
(2)阳极上的电极铁失去电子:Fe-2e-=Fe2+,二价铁离子有还原性,Cr2O72-有强氧化性,二者能发生氧化还原反应,二价铁离子被氧化成三价铁离子,Cr2O72-被还原为Cr3+,反应方程式为:Cr2O72-+6Fe2++14H+═2Cr3++6Fe3++7H2O,
故答案为:Fe-2e-=Fe2+;6Fe2++Cr2O72-+11H2O=6Fe(OH)3↓+2Cr3++4H+;
(3)制备中利用的原料,在转化过程中又生成的可以循环利用;由转化关系图知,通入氧气的一极为原电池的正极,其电极反应式为O2+4e-+2CO2=2CO32-,同时负极发生氧化反应,甲烷失去电子,在碱性条件下生成碳酸根离子,负极反应为:CH4+10OH--8e-=CO32-+7H2O,即A为CO2,同时可以判定CO2可以循环利用,
故答案为:CO2;
(4)同周期元素从左到右元素的金属性逐渐减弱,CS是元素周期表第六周期第ⅠA族元素,所以元素的金属性最强的是CS,氢氧化物中碱性最强的为CsOH,Ce(OH)3和Ce(OH)4中Ce的化合价分别为+3和+4,Ce(OH)3易被氧气氧化成Ce(OH)4,反应为:4Ce(OH)3+O2+2H2O=4Ce(OH)4,空气中含有水蒸气和氧气,所以Ce(OH)3对空气比较敏感,
故答案为:CsOH;4Ce(OH)3+O2+2H2O=4Ce(OH)4;
点评:本题综合考查了原电池原理和电解池原理以及元素递变规律,需要学生具有扎实的基础知识与灵活运用知识解决问题的能力,对工艺流程的理解、阅读题目获取信息是解题的关键,做题时要注意电极的判断及化学方程式的书写,题目难度中等.

练习册系列答案
 期末复习检测系列答案
期末复习检测系列答案 超能学典单元期中期末专题冲刺100分系列答案
超能学典单元期中期末专题冲刺100分系列答案 黄冈360度定制密卷系列答案
黄冈360度定制密卷系列答案 阳光考场单元测试卷系列答案
阳光考场单元测试卷系列答案
相关题目
几种短周期元素的原子半径及主要化合价如下表
下列说法正确的是( )
| 元素代号 | L | M | X | R | T |
| 原子半径(nm) | 0.160 | 0.143 | 0.102 | 0.089 | 0.074 |
| 主要化合价 | +2 | +3 | +6、-2 | +2 | -2 |
| A、L、T形成的简单离子核外电子数相等 |
| B、R的氧化物对应的水化物呈强碱性 |
| C、X单质在氧气中燃烧生成XO3 |
| D、离子半径大小:r(M3+)>r(T2-) |
下列说法正确的是( )


| A、图1表示pH相同的盐酸和醋酸加水稀释时溶液导电能力的变化 |
| B、图1表示物质的量浓度相同的盐酸和醋酸加水稀释时溶液导电能力的变化 |
| C、图2中,t℃时饱和溶液的质量分数为m% |
| D、图2中,若保持温度不变,可以通过添加溶质的方法使溶液组成从a点变为b点 |
以H2、O2、熔融盐Na2CO3组成的燃料电池来电解制备N2O5,装置如图所示,其中Y为CO2.下列说法错误的是
( )

( )

| A、石墨Ⅱ电极上发生反应的电极反应式为:O2+4e-+2CO2═2CO32- |
| B、在电解池中生成N2O5的电极反应式为:N2O4+2NO3--2e-═2N2O5 |
| C、放电时熔融盐中CO32-向石墨I电极方向移动 |
| D、每消耗11.2L氢气,理论上可以制得108g N2O5 |
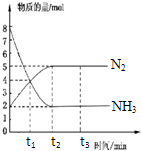 在体积一定的密闭容器中发生反应:2NH3(g)?N2(g)+3H2(g),在673K、30MPa下,n(NH3)和n(N2)随时间变化的关系如图所示.下列叙述正确的是( )
在体积一定的密闭容器中发生反应:2NH3(g)?N2(g)+3H2(g),在673K、30MPa下,n(NH3)和n(N2)随时间变化的关系如图所示.下列叙述正确的是( )| A、t1时反应达到平衡 |
| B、t3时,v正(N2)>v逆(N2) |
| C、t2时和t3时n(H2)相等 |
| D、t3后,若体积不变充He,反应速率增大 |
 NA表示阿伏加德罗常数的值,下列说法正确的是( )
NA表示阿伏加德罗常数的值,下列说法正确的是( )| A、0.5mol雄黄(As4S4结构如图)含有NA个S-S键 | ||||
| B、7.8g Na2S和7.8g Na2O2中含有的阴离子数目均为0.1NA | ||||
C、1.8g
| ||||
| D、氧原子总数为0.2NA的SO2和O2的混合气体,其体积为2.24L |
某一元弱酸HA的相对分子质量为M.在t℃时,将a gHA完全溶解于水,得VmL饱和溶液,测得该溶液的密度为ρg?cm-3,其中n(A-)为bmol.下列叙述,错误的是( )
A、溶液中c(H+)=
| ||
B、物质的量浓度c(HA)=
| ||
C、t℃时,HA的溶解度S=
| ||
D、HA的质量分数w(HA)=
|