题目内容
中学化学中常见的几种物质存在如图1的关系,其中甲和乙是生活中常见的金属单质,D是红棕色气体.(图中部分产物和反应条件略去)
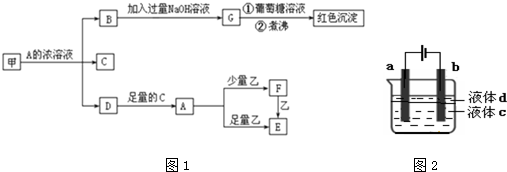
回答下列问题:
(1)乙元素在元素周期表中的位置: ;
(2)解释图中B→G加入过量NaOH溶液的目的: ;
(3)C的电子式: ;
(4)A溶液与一种能使湿润的红色石蕊试纸变蓝的气体反应,生成一种盐,该盐的水溶液呈酸性,其原因是(用离子方程式表示): ;
(5)写出将溶液F加热蒸干、灼烧到质量不再减少时所得固体X加入到氢碘酸中的离子方程式: ;
(6)向溶液E中加入NaOH溶液可以得到白色沉淀Y,可用电解法制得纯净的Y.(如图2)
①a电极上的电极反应为 ;
②电解液c可以是
A.蒸馏水 B.NaOH溶液
C.无水乙醇 D.稀H2SO4.

回答下列问题:
(1)乙元素在元素周期表中的位置:
(2)解释图中B→G加入过量NaOH溶液的目的:
(3)C的电子式:
(4)A溶液与一种能使湿润的红色石蕊试纸变蓝的气体反应,生成一种盐,该盐的水溶液呈酸性,其原因是(用离子方程式表示):
(5)写出将溶液F加热蒸干、灼烧到质量不再减少时所得固体X加入到氢碘酸中的离子方程式:
(6)向溶液E中加入NaOH溶液可以得到白色沉淀Y,可用电解法制得纯净的Y.(如图2)
①a电极上的电极反应为
②电解液c可以是
A.蒸馏水 B.NaOH溶液
C.无水乙醇 D.稀H2SO4.
考点:无机物的推断
专题:推断题
分析:D是红棕色气体,说明D是二氧化氮;甲和乙是生活中常见的金属单质,二氧化氮和足量C反应生成的A和金属反应,证明A为酸,则反应为D二氧化氮和水反应生成硝酸;由硝酸和少量乙反应生成F,和过量乙反应生成E,F和乙又可生成E,可知乙为金属铁,而F为硝酸铁,E为硝酸亚铁,G和葡萄糖在碱性溶液中加热反应生成红色沉淀,说明G为氢氧化铜,B为硝酸铜,判断甲为Cu,然后进行一一验证即可.
解答:
解:D是红棕色气体,说明D是二氧化氮;甲和乙是生活中常见的金属单质,二氧化氮和足量C反应生成的A和金属反应,证明A为酸,则反应为D二氧化氮和水反应生成硝酸;由硝酸和少量乙反应生成F,和过量乙反应生成E,F和乙又可生成E,可知乙为金属铁,而F为硝酸铁,E为硝酸亚铁,G和葡萄糖在碱性溶液中加热反应生成红色沉淀,说明G为氢氧化铜,B为硝酸铜,判断甲为Cu;
(1)上述分析判断乙为Fe,铁元素在元素周期表中的位置是第四周期第ⅤⅢ族;
故答案为:第四周期第ⅤⅢ族;
(2)B→G加入过量NaOH溶液的目的是因为葡萄糖中醛基和氢氧化铜反应的条件是强碱溶液中加热发生反应生成红色沉淀;
故答案为:醛基和氢氧化铜的反应是在强碱性条件下进行;
(3)C为水,水分子为共价化合物,书写的电子式为: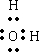 ;
;
故答案为: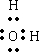 ;
;
(4)A溶液为硝酸溶液,与一种能使湿润的红色石蕊试纸变蓝的气体氨气反应,生成硝酸铵,该盐的水溶液呈酸性是因为铵根离子水解显酸性,水解的离子方程式为:NH4++H2O?NH3?H2O+H+;
(5)溶液F为硝酸铁溶液,加热蒸干、灼烧到质量不再减少时所得固体X为Fe2O3,加入到氢碘酸中,铁离子具有氧化性氧化碘离子为单质碘,反应的离子方程式为:Fe2O3+6H++2I-=2Fe2++I2+3H2O;
故答案为:Fe2O3+6H++2I-=2Fe2++I2+3H2O;
(6)向溶液E为硝酸亚铁溶液,溶液中加入NaOH溶液可以得到白色沉淀Y为氢氧化亚铁沉淀,可用电解法制得纯净的Y氢氧化亚铁,铁做阳极电极反应为:Fe-2e-=Fe2+,电解液为氢氧化钠溶液,蒸馏水电离程度小不易生成氢氧化亚铁沉淀,稀硫酸不能生成沉淀,乙醇是非电解质不导电;
故答案为:Fe-2e-=Fe2+,B;
(1)上述分析判断乙为Fe,铁元素在元素周期表中的位置是第四周期第ⅤⅢ族;
故答案为:第四周期第ⅤⅢ族;
(2)B→G加入过量NaOH溶液的目的是因为葡萄糖中醛基和氢氧化铜反应的条件是强碱溶液中加热发生反应生成红色沉淀;
故答案为:醛基和氢氧化铜的反应是在强碱性条件下进行;
(3)C为水,水分子为共价化合物,书写的电子式为:
 ;
;故答案为:
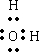 ;
;(4)A溶液为硝酸溶液,与一种能使湿润的红色石蕊试纸变蓝的气体氨气反应,生成硝酸铵,该盐的水溶液呈酸性是因为铵根离子水解显酸性,水解的离子方程式为:NH4++H2O?NH3?H2O+H+;
(5)溶液F为硝酸铁溶液,加热蒸干、灼烧到质量不再减少时所得固体X为Fe2O3,加入到氢碘酸中,铁离子具有氧化性氧化碘离子为单质碘,反应的离子方程式为:Fe2O3+6H++2I-=2Fe2++I2+3H2O;
故答案为:Fe2O3+6H++2I-=2Fe2++I2+3H2O;
(6)向溶液E为硝酸亚铁溶液,溶液中加入NaOH溶液可以得到白色沉淀Y为氢氧化亚铁沉淀,可用电解法制得纯净的Y氢氧化亚铁,铁做阳极电极反应为:Fe-2e-=Fe2+,电解液为氢氧化钠溶液,蒸馏水电离程度小不易生成氢氧化亚铁沉淀,稀硫酸不能生成沉淀,乙醇是非电解质不导电;
故答案为:Fe-2e-=Fe2+,B;
点评:本题为框图型物质推断题,完成此类题目,可以依据题干提供的信息,结合框图,找准解题的突破口,直接得出物质的化学式,然后顺推或逆推或由两边向中间推得出其他物质的化学式,题目难度中等.

练习册系列答案
相关题目
下列溶液中各微粒浓度关系判定不正确的是( )
| A、10mL 0.2 mol?L-1的氨水与10mL 0.1mol?L-1的盐酸充分反应混合后的溶液中,存在:c(NH4+)+c(NH3?H2O)=2c(Cl-)=0.1mol?L-1 |
| B、已知酸性HF>CH3COOH,物质的量浓度相等的NaF与CH3COOK溶液中:c(Na+)-c(F-)>c(K+)-c(CH3COO-) |
| C、CH3COOK溶液中加入少量NaNO3固体后的碱性溶液一定有:c(K+)+c(H+)=c(CH3COO-)+c(OH-) |
| D、NaHSO3溶液中一定有:c(Na+)>c(HSO3-)>c(SO32-)>c(H2SO3) |
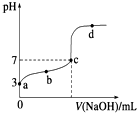 常温下下向20mL 0.1mol?L-1 CH3COOH溶液中逐滴加入0.1mol?L-1 NaOH溶液,其pH变化曲线如图所示(忽略温度变化).下列说法中不正确的是( )
常温下下向20mL 0.1mol?L-1 CH3COOH溶液中逐滴加入0.1mol?L-1 NaOH溶液,其pH变化曲线如图所示(忽略温度变化).下列说法中不正确的是( )| A、a点表示的溶液中c(CH3COO-)等于10-3mol?L-1 |
| B、b点表示的溶液中c(CH3COO-)>c(Na+) |
| C、c点表示的溶液中c(CH3COO-)=c(Na+) |
| D、d点表示的溶液中c(Na+)>c(CH3COO->c(OH-)>c(H+) |
下列化学用语表示正确的是( )
A、原子核中有6个中子的硼原子:
| ||
B、HCl的电子式: | ||
C、K+结构示意图: | ||
| D、HClO的结构式:H-O-Cl |
 高铁酸盐在能源环保领域有广泛用途.用镍(Ni)、铁作电极电解浓NaOH溶液制备高铁酸钠(Na2FeO4)的装置如图所示.下列说法正确的是( )
高铁酸盐在能源环保领域有广泛用途.用镍(Ni)、铁作电极电解浓NaOH溶液制备高铁酸钠(Na2FeO4)的装置如图所示.下列说法正确的是( )| A、铁是阳极,电极反应为Fe-2e-+2OH-═Fe(OH)2 |
| B、电解一段时间后,镍电极附近溶液的pH减小 |
| C、若离子交换膜为阴离子交换膜,则电解过程中氢氧根向阳极移动 |
| D、每制得1mol Na2FeO4,理论上可以产生67.2L气体 |
下列有关的离子方程式正确的是( )
| A、向FeCl3溶液中加入Mg(OH)2:3Mg(OH)2+2Fe3+═2Fe(OH)3+3Mg2+ | ||||
B、铜片接电源正极,碳棒接电源负极,电解硫酸铜溶液:Cu+2H+
| ||||
| C、在100mL浓度为1mol?L-1的Fe(NO3)3的溶液中通入足量SO2 2Fe3++SO2+2H2O═2Fe2++SO42-+4H+ | ||||
| D、实验室配制的亚铁盐溶液在空气中被氧化:4Fe2++O2+2H2O═4Fe3++4OH- |


