题目内容
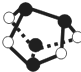 NA表示阿伏加德罗常数的值,下列说法正确的是( )
NA表示阿伏加德罗常数的值,下列说法正确的是( )| A、0.5mol雄黄(As4S4结构如图)含有NA个S-S键 | ||||
| B、7.8g Na2S和7.8g Na2O2中含有的阴离子数目均为0.1NA | ||||
C、1.8g
| ||||
| D、氧原子总数为0.2NA的SO2和O2的混合气体,其体积为2.24L |
考点:阿伏加德罗常数
专题:阿伏加德罗常数和阿伏加德罗定律
分析:A.根据雄黄的结构简式可知,黑球为As,白球为S,雄黄中不存在S-S键;
B.硫化钠与过氧化钠的摩尔质量都是78g/mol,过氧化钠中阴离子为过氧根离子;
C.1.8g
O2分子中含有的中子的物质的量为:
×16=0.9mol,1.8g
O3分子中含有中子的物质的量为:
×30=1mol;
D.没有告诉在标况下,题中条件无法计算混合气体的体积.
B.硫化钠与过氧化钠的摩尔质量都是78g/mol,过氧化钠中阴离子为过氧根离子;
C.1.8g
16 8 |
| 1.8g |
| 32g/mol |
18 8 |
| 1.8g |
| 54g/mol |
D.没有告诉在标况下,题中条件无法计算混合气体的体积.
解答:
解:A.S原子最外层6个电子,能够形成2个共价键,As最外层5电子,能够形成3个共价键,所以该结构简式中,黑球为As原子,白球为S原子,该结构简式中不存在S-S键,故A错误;
B.7.8g Na2S和7.8g Na2O2的物质的量为0.1mol,过氧化钠中阴离子为过氧根离子,0.1mol硫化钠和0.1mol过氧化钠中含有0.1mol阴离子,含有的阴离子数目均为0.1NA,故B正确;
C.1.8g
O2分子中含有的中子:
×16=0.9mol,1.8g
O3分子中含有中子的物质的量为:
×30=1mol,二者含有的中子数不相同,故C正确;
D.氧原子总数为0.2NA的SO2和O2的混合气体的物质的量为0.1mol,没有告诉在标况下,不能使用标况下的气体摩尔体积计算0.1mol混合气体的体积,故D错误;
故选B.
B.7.8g Na2S和7.8g Na2O2的物质的量为0.1mol,过氧化钠中阴离子为过氧根离子,0.1mol硫化钠和0.1mol过氧化钠中含有0.1mol阴离子,含有的阴离子数目均为0.1NA,故B正确;
C.1.8g
16 8 |
| 1.8g |
| 32g/mol |
18 8 |
| 1.8g |
| 54g/mol |
D.氧原子总数为0.2NA的SO2和O2的混合气体的物质的量为0.1mol,没有告诉在标况下,不能使用标况下的气体摩尔体积计算0.1mol混合气体的体积,故D错误;
故选B.
点评:本题考查阿伏加德罗常数的有关计算和判断,题目难度中等,注意明确标况下气体摩尔体积的使用条件,要求学生掌握好以物质的量为中心的各化学量与阿伏加德罗常数的关系,准确弄清分子、原子、原子核内质子中子及核外电子的构成关系.选项A为难点和易错点,注意合理分析雄黄的结构简式.

练习册系列答案
 全能测控期末小状元系列答案
全能测控期末小状元系列答案
相关题目
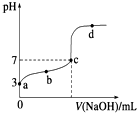 常温下下向20mL 0.1mol?L-1 CH3COOH溶液中逐滴加入0.1mol?L-1 NaOH溶液,其pH变化曲线如图所示(忽略温度变化).下列说法中不正确的是( )
常温下下向20mL 0.1mol?L-1 CH3COOH溶液中逐滴加入0.1mol?L-1 NaOH溶液,其pH变化曲线如图所示(忽略温度变化).下列说法中不正确的是( )| A、a点表示的溶液中c(CH3COO-)等于10-3mol?L-1 |
| B、b点表示的溶液中c(CH3COO-)>c(Na+) |
| C、c点表示的溶液中c(CH3COO-)=c(Na+) |
| D、d点表示的溶液中c(Na+)>c(CH3COO->c(OH-)>c(H+) |
 高铁酸盐在能源环保领域有广泛用途.用镍(Ni)、铁作电极电解浓NaOH溶液制备高铁酸钠(Na2FeO4)的装置如图所示.下列说法正确的是( )
高铁酸盐在能源环保领域有广泛用途.用镍(Ni)、铁作电极电解浓NaOH溶液制备高铁酸钠(Na2FeO4)的装置如图所示.下列说法正确的是( )| A、铁是阳极,电极反应为Fe-2e-+2OH-═Fe(OH)2 |
| B、电解一段时间后,镍电极附近溶液的pH减小 |
| C、若离子交换膜为阴离子交换膜,则电解过程中氢氧根向阳极移动 |
| D、每制得1mol Na2FeO4,理论上可以产生67.2L气体 |
胡妥油(D)用作香料的原料,它可由A合成得到:

下列说法正确的是( )

下列说法正确的是( )
| A、若有机物A是由异戊二烯(C5H8)和丙烯酸(C3H4O2)加热得到的,则该反应的反应类型属于加成反应 |
| B、有机物D分子中所有碳原子一定共面 |
| C、有机物C 的所有同分异构体中不可有芳香族化合物存在 |
| D、有机物B 既能跟Na反应放出H2,又能跟NaHCO3溶液反应放出CO2气体 |
化学无处不在,下面说法正确的是( )
| A、“地沟油”禁止食用,但可用于制造生物柴油 |
| B、“PM2.5”是指大气中直径小于或等于2.5μm(1μm=1×10-6m)的颗粒,“PM2.5”与空气形成的分散系属于胶体 |
| C、红宝石、水晶、玻璃、陶瓷等都是硅酸盐制品 |
| D、分馏、裂化、裂解是利用化学变化来炼制加工石油的三种重要方法 |
对下列与化学有关的社会和生活问题作出判断,其中正确的是( )
| A、煤经过气化和液化等物理变化可以转化为清洁燃料 |
| B、大型制冷设备的液氨大量泄漏不会对操作人员造成伤害 |
| C、Al(SO4)3可用于对自来水进行杀菌消毒 |
| D、静电除尘与胶体的基本性质有一定联系 |
下列有关的离子方程式正确的是( )
| A、向FeCl3溶液中加入Mg(OH)2:3Mg(OH)2+2Fe3+═2Fe(OH)3+3Mg2+ | ||||
B、铜片接电源正极,碳棒接电源负极,电解硫酸铜溶液:Cu+2H+
| ||||
| C、在100mL浓度为1mol?L-1的Fe(NO3)3的溶液中通入足量SO2 2Fe3++SO2+2H2O═2Fe2++SO42-+4H+ | ||||
| D、实验室配制的亚铁盐溶液在空气中被氧化:4Fe2++O2+2H2O═4Fe3++4OH- |
