题目内容
6.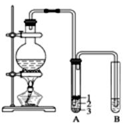 实验室制取少量溴乙烷的装置如图所示.根据题意完成下列填空:
实验室制取少量溴乙烷的装置如图所示.根据题意完成下列填空:(1)盛放反应物的仪器名称是圆底烧瓶,其中加入的反应物是溴化钠、乙醇和 1:1的硫酸.
(2)将生成物导入盛有冰水混合物的试管 A中,冰水混合物的作用是
冷却、液封溴乙烷.试管 A中的物质分为三层(如图所示),产物在第3层.
(3)试管 A中除了产物和水之外,还可能存在HBr、CH3CH2OH(写出化学
式).
(4)用浓的硫酸进行实验,若试管 A中获得的有机物呈棕黄色,除去其中杂质
的正确方法是d(选填编号).
a.蒸馏
c.用四氯化碳萃取
b.用氢氧化钠溶液洗涤
d.用亚硫酸钠溶液洗涤
(5)若试管 B中的酸性高锰酸钾溶液褪色,使之褪色的物质的名称是乙烯.
分析 (1)由图可知,仪器的名称;NaBr与浓硫酸反应生成HBr,HBr与乙醇发生取代反应生成溴乙烷;
(2)冰水混合物可冷却生成物,溴乙烷的密度比水大;
(3)结合反应可知生成物;
(4)试管A中获得的有机物呈棕黄色,含溴单质,溴乙烷、溴均与碱反应,但溴乙烷与亚硫酸钠不反应,反应后分液可分离;
(5)乙烯能被高锰酸钾氧化;
解答 解:(1)由图可知,盛放反应物的仪器名称是圆底烧瓶;其中加入的反应物是溴化钠、乙醇和1:1的硫酸;故答案为:圆底烧瓶;乙醇;
(2)将生成物导入盛有冰水混合物的试管A中,冰水混合物的作用是冷却、液封溴乙烷,溴乙烷的密度比水大,则产物在第3层,
故答案为:冷却、液封溴乙烷;3;
(3)由NaBr+H2SO4═HBr+NaHSO4、CH3CH2OH+HBr$\stackrel{△}{→}$CH3CH2Br+H2O可知,试管A中除了产物和水之外,还可能存在HBr、CH3CH2OH,
故答案为:HBr;CH3CH2OH;
(4)试管A中获得的有机物呈棕黄色,含溴单质,溴乙烷、溴均与碱反应,但溴乙烷与亚硫酸钠不反应,则选择除杂试剂为d;故答案为:d;
(5)乙醇在浓硫酸作用下可发生消去反应生成乙烯,能被高锰酸钾氧化,可知试管B中的酸性高锰酸钾溶液褪色,使之褪色的物质的名称是乙烯,
故答案为:乙烯.
点评 本题考查制备实验方案的设计,为高频考点,把握制备实验原理、实验装置的作用、习题中的信息为解答的关键,侧重分析与实验能力的综合考查,题目难度中等.

练习册系列答案
 全优点练单元计划系列答案
全优点练单元计划系列答案
相关题目
6.下列反应属于吸热反应的是( )
| A. | 炭燃烧生成一氧化碳 | B. | Ba(OH)2•8H2O与NH4Cl反应 | ||
| C. | 锌粒与稀硫酸反应制取H2 | D. | 中和反应 |
7.可逆反应达到平衡状态的主要特征是( )
| A. | 正、逆反应的速率均为零 | B. | 正、逆反应都还在进行 | ||
| C. | 正、逆反应的速率相等 | D. | 反应停止了 |
18.下列关于钠的叙述中,不正确的是( )
| A. | 钠燃烧时生成氧化钠 | B. | 钠有很强的还原性 | ||
| C. | 钠原子的最外层只有一个电子 | D. | 钠燃烧时发出黄色火焰 |
15.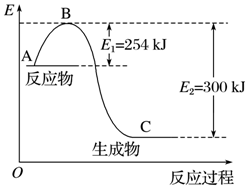 氮是地球上含量丰富的一种元素,氮及其化合物在工农业生产、生活中有着重要作用.
氮是地球上含量丰富的一种元素,氮及其化合物在工农业生产、生活中有着重要作用.
(1)如图是N2(g)和H2(g)反应生成1mol NH3(g)过程中能量的变化示意图,请写出N2和H2反应的热化学方程式:N2(g)+3H2(g)=2NH3(g)△H=-92KJ/mol.
(2)若已知下列数据:
试根据表中及图中数据计算N-H的键能:390kJ•mol-1.
(3)用NH3催化还原NOx还可以消除氮氧化物的污染.已知:
4NH3(g)+3O2(g)═2N2+6H2O(g)△H1=-a kJ•mol-1①
N2(g)+O2(g)═2NO(g)△H2=-b kJ•mol-1②
求:若1mol NH3还原NO至N2,则该反应过程中的反应热△H3=$\frac{3b-a}{4}$kJ•mol-1(用含a、b的式子表示).
(4)捕碳技术(主要指捕获CO2)在降低温室气体排放中具有重要的作用.目前NH3和(NH4)2CO3已经被用作工业捕碳剂,它们与CO2可发生如下可逆反应:
反应Ⅰ:2NH3(l)+H2O(l)+CO2(g)?(NH4)2CO3(aq)△H1
反应Ⅱ:NH3(l)+H2O(l)+CO2(g)?NH4HCO3(aq)△H2
反应Ⅲ:(NH4)2CO3(aq)+H2O(l)+CO2(g)?2NH4HCO3(aq)△H3
请回答下列问题:
△H3与△H1、△H2之间的关系是△H3=2△H2-△H1.
 氮是地球上含量丰富的一种元素,氮及其化合物在工农业生产、生活中有着重要作用.
氮是地球上含量丰富的一种元素,氮及其化合物在工农业生产、生活中有着重要作用.(1)如图是N2(g)和H2(g)反应生成1mol NH3(g)过程中能量的变化示意图,请写出N2和H2反应的热化学方程式:N2(g)+3H2(g)=2NH3(g)△H=-92KJ/mol.
(2)若已知下列数据:
| 化学键 | H-H | N≡N |
| 键能/kJ•mol-1 | 435 | 943 |
(3)用NH3催化还原NOx还可以消除氮氧化物的污染.已知:
4NH3(g)+3O2(g)═2N2+6H2O(g)△H1=-a kJ•mol-1①
N2(g)+O2(g)═2NO(g)△H2=-b kJ•mol-1②
求:若1mol NH3还原NO至N2,则该反应过程中的反应热△H3=$\frac{3b-a}{4}$kJ•mol-1(用含a、b的式子表示).
(4)捕碳技术(主要指捕获CO2)在降低温室气体排放中具有重要的作用.目前NH3和(NH4)2CO3已经被用作工业捕碳剂,它们与CO2可发生如下可逆反应:
反应Ⅰ:2NH3(l)+H2O(l)+CO2(g)?(NH4)2CO3(aq)△H1
反应Ⅱ:NH3(l)+H2O(l)+CO2(g)?NH4HCO3(aq)△H2
反应Ⅲ:(NH4)2CO3(aq)+H2O(l)+CO2(g)?2NH4HCO3(aq)△H3
请回答下列问题:
△H3与△H1、△H2之间的关系是△H3=2△H2-△H1.
14.某校化学兴趣小组采用酸碱中和滴定法测定学校新购入的烧碱的纯度(烧碱中含有不与酸反应的杂质),试根据实验回答.
(1)实验步骤为:①用托盘天平准确称量4.1g烧碱样品.
②将样品配成250ml待测液,需要的仪器除玻璃棒、量筒、烧杯外还需要的玻璃仪器有250ml容量瓶,胶头滴管.
③用碱式滴定管量取10.00ml待测液,注入锥形瓶中.
④在锥形瓶中滴入2~3滴酚酞或甲基橙(填指示剂),用0.2010mol/L的标准盐酸滴定待测烧碱溶液,滴定时左手旋转酸式滴定管的玻璃活塞,右手不停地摇动锥形瓶,两眼注视锥形瓶内溶液颜色的变化,直到滴定终点.
(2)该小组测得下列数据
根据上述数据,计算烧碱的纯度98%.
(1)实验步骤为:①用托盘天平准确称量4.1g烧碱样品.
②将样品配成250ml待测液,需要的仪器除玻璃棒、量筒、烧杯外还需要的玻璃仪器有250ml容量瓶,胶头滴管.
③用碱式滴定管量取10.00ml待测液,注入锥形瓶中.
④在锥形瓶中滴入2~3滴酚酞或甲基橙(填指示剂),用0.2010mol/L的标准盐酸滴定待测烧碱溶液,滴定时左手旋转酸式滴定管的玻璃活塞,右手不停地摇动锥形瓶,两眼注视锥形瓶内溶液颜色的变化,直到滴定终点.
(2)该小组测得下列数据
| 滴定次数 | 待测液体积/ml | 标准盐酸体积/ml | |
| 滴定前读数/ml | 滴定后读数/ml | ||
| 第一次 | 10.00 | 0.20 | 22.90 |
| 第二次 | 10.00 | 0.50 | 20.40 |
| 第三次 | 10.00 | 4.00 | 24.10 |
| 第四次 | 10.00 | 0.00 | 20.00 |


 ;
;