题目内容
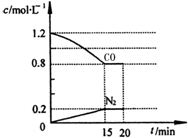
14.在一容积为2L的密闭容器内加入0.2mol的N2和0.6mol的H2,在一定条件下发生如下反应:N2(g)+3H2(g)?2NH3(g )△H<0,反应中NH3的物质的量浓度的变化的情况如图:
(1)根据上图,计算从反应开始到平衡时,平均反应速率v(NH3)为0.025mol/(L•min).
(2)反应达到平衡后,第5分钟末,保持其它条件不变,若改变反应温度,则NH3的物质的量浓度不可能为AC.
A.0.20mol/L B.0.12mol/L C.0.10mol/L D. 0.08mol/L
(3)反应达到平衡后,第5分钟末,保持其它条件不变,若只把容器的体积缩小一半,平衡正反应方向移动(填“向逆反应方向”、“向正反应方向”或“不”)
分析 (1)由图可知,0~4min生成氨气为0.10mol/L,结合v=$\frac{△c}{△t}$计算;
(2)到平衡后,氨气的浓度为0.10mol/L,第5分钟末,保持其它条件不变,若降低温度,平衡正向移动;若升高温度,平衡逆向移动;
(3)平衡后,保持其它条件不变,若只把容器的体积缩小一半,则压强增大,该反应为气体体积减小的反应,以此来解答.
解答 解:(1)由图可知,4min达到平衡,0~4min生成氨气为0.10mol/L,平均反应速率v(NH3)=$\frac{0.1mol/L}{4min}$=0.025 mol/(L•min),
故答案为:0.025 mol/(L•min);
(2)到平衡后,氨气的浓度为0.10mol/L,第5分钟末,保持其它条件不变,该反应为放热反应,
若降低温度,平衡正向移动,则氨气的浓度增大,但为可逆反应,不能完全转化,可知0.10mol/L<c(NH3)<0.2mol/L;
若升高温度,平衡逆向移动,氨气的浓度减小,可知0<c(NH3)<0.1mol/L,
则NH3的物质的量浓度不可能为0.2mol/L、0.1mol/L,
故答案为:AC;
(3)平衡后,保持其它条件不变,若只把容器的体积缩小一半,则压强增大,该反应为气体体积减小的反应,可知压强增大平衡向正反应方向移动,
故答案为:正反应方向.
点评 本题考查浓度随时间的变化曲线,为高频考点,把握速率计算、平衡移动及图象分析为解答的关键,侧重分析与应用能力的考查,注意该反应为放热反应,(2)为易错点,题目难度不大.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
14.下列化学式中只能表示一种物质的是( )
| A. | C3H7OH | B. | C2H4 | C. | C2H6O | D. | C3H6O2 |
2. 某温度下,Fe(OH)3(s)、Cu(OH)2(s)分别在溶液中达到沉淀溶解平衡后,改变溶液pH,金属阳离子浓度的变化如图所示.据图分析,下列判断错误的是( )
某温度下,Fe(OH)3(s)、Cu(OH)2(s)分别在溶液中达到沉淀溶解平衡后,改变溶液pH,金属阳离子浓度的变化如图所示.据图分析,下列判断错误的是( )
 某温度下,Fe(OH)3(s)、Cu(OH)2(s)分别在溶液中达到沉淀溶解平衡后,改变溶液pH,金属阳离子浓度的变化如图所示.据图分析,下列判断错误的是( )
某温度下,Fe(OH)3(s)、Cu(OH)2(s)分别在溶液中达到沉淀溶解平衡后,改变溶液pH,金属阳离子浓度的变化如图所示.据图分析,下列判断错误的是( )| A. | Ksp[Fe(OH)3]<Ksp[Cu(OH)2] | |
| B. | Fe(OH)3、Cu(OH)2分别在b、c两点代表的溶液中达到饱和 | |
| C. | 加适量NH4Cl固体可使溶液由a点变到b点 | |
| D. | c、d两点代表的溶液中c(H+)与c(OH-)乘积相等 |
 新近出版的《前沿科学》杂志刊发的中国环境科学研究院研究员的论文《汽车尾气污染及其危害》,其中系统地阐述了汽车尾气排放对大气环境及人体健康造成的严重危害.目前降低尾气的可行方法是在汽车排气管上安装催化转化器.NO和CO气体均为汽车尾气的成分,这两种气体在催化转换器中发生反应:2CO(g)+2NO(g)?N2(g)+2CO2(g)△H=-a kJ•mol-1.
新近出版的《前沿科学》杂志刊发的中国环境科学研究院研究员的论文《汽车尾气污染及其危害》,其中系统地阐述了汽车尾气排放对大气环境及人体健康造成的严重危害.目前降低尾气的可行方法是在汽车排气管上安装催化转化器.NO和CO气体均为汽车尾气的成分,这两种气体在催化转换器中发生反应:2CO(g)+2NO(g)?N2(g)+2CO2(g)△H=-a kJ•mol-1.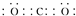 .
.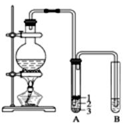 实验室制取少量溴乙烷的装置如图所示.根据题意完成下列填空:
实验室制取少量溴乙烷的装置如图所示.根据题意完成下列填空: