题目内容
7.可逆反应达到平衡状态的主要特征是( )| A. | 正、逆反应的速率均为零 | B. | 正、逆反应都还在进行 | ||
| C. | 正、逆反应的速率相等 | D. | 反应停止了 |
分析 可逆反应达到平衡状态,正反应速率和逆反应速率相等,各组分的浓度、百分含量不再变化,但是反应没有停止,正逆反应速率不等于0,反应物不可能完全转化成生成物.
解答 解:A、可逆反应达到平衡状态,正逆反应速率相等,正逆反应仍在继续进行,所以正、逆反应速率都不为零,故A错误;
B、可逆反应达到平衡状态,正逆反应速率相等,各组分的浓度不变,但是达到平衡状态,正逆反应仍在继续进行,反应没有停止,故B错误;
C、正、逆反应的速率相等,说明反应达到平衡状态,各组分的浓度不再变化,故C正确;
D、达到了平衡状态,正逆反应仍在继续进行,反应没有停止,故D错误;
故选C.
点评 本题考查化学平衡状态的判断,题目难度不大,注意化学平衡状态的根本标志是:①v(正) =v(逆),②各组分百分含量不变;注意达到平衡状态,正逆反应速率不等于0,反应不会停止,试题培养了学生灵活应用所学知识的能力.

练习册系列答案
 口算心算速算应用题系列答案
口算心算速算应用题系列答案 同步拓展阅读系列答案
同步拓展阅读系列答案
相关题目
17.下列可用于测定溶液pH且精确度最高的是( )
| A. | 酸碱指示剂 | B. | pH计 | C. | 红色石蕊试纸 | D. | 广泛pH试纸 |
2.在下列反应中,水既不是氧化剂,也不是还原剂的是( )
| A. | 2Na+2H2O=2NaOH+H2↑ | B. | C12+H2O=HC1+HC1O | ||
| C. | 2F2+2H2O=4HF+O2 | D. | 2H2O$\frac{\underline{\;通电\;}}{\;}$2H2↑+O2↑ |
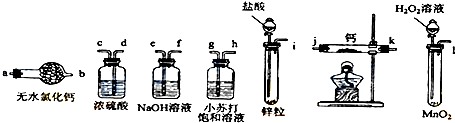
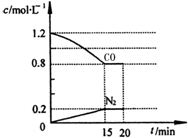 新近出版的《前沿科学》杂志刊发的中国环境科学研究院研究员的论文《汽车尾气污染及其危害》,其中系统地阐述了汽车尾气排放对大气环境及人体健康造成的严重危害.目前降低尾气的可行方法是在汽车排气管上安装催化转化器.NO和CO气体均为汽车尾气的成分,这两种气体在催化转换器中发生反应:2CO(g)+2NO(g)?N2(g)+2CO2(g)△H=-a kJ•mol-1.
新近出版的《前沿科学》杂志刊发的中国环境科学研究院研究员的论文《汽车尾气污染及其危害》,其中系统地阐述了汽车尾气排放对大气环境及人体健康造成的严重危害.目前降低尾气的可行方法是在汽车排气管上安装催化转化器.NO和CO气体均为汽车尾气的成分,这两种气体在催化转换器中发生反应:2CO(g)+2NO(g)?N2(g)+2CO2(g)△H=-a kJ•mol-1.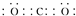 .
.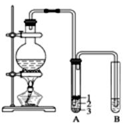 实验室制取少量溴乙烷的装置如图所示.根据题意完成下列填空:
实验室制取少量溴乙烷的装置如图所示.根据题意完成下列填空: