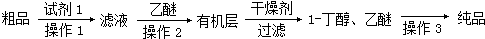题目内容
18.下列关于钠的叙述中,不正确的是( )| A. | 钠燃烧时生成氧化钠 | B. | 钠有很强的还原性 | ||
| C. | 钠原子的最外层只有一个电子 | D. | 钠燃烧时发出黄色火焰 |
分析 A.Na燃烧生成过氧化钠;
B.钠原子最外层只有一个电子,易失电子作还原剂;
C.钠原子最外层只与一个电子,还原性较强;
D.钠元素焰色反应呈黄色.
解答 解:A.Na燃烧生成淡黄色固体过氧化钠,和氧气接触生成白色固体氧化钠,故A错误;
B.钠原子最外层只有一个电子,易失电子作还原剂,所以Na体现较强的还原性,故B正确;
C.钠原子最外层只与一个电子,还原性较强,常作还原剂,故C正确;
D.钠元素焰色反应呈黄色,所以Na燃烧发出黄色火焰,生成淡黄色过氧化钠固体,故D正确;
故选A.
点评 本题考查钠的性质,侧重考查学生分析判断能力,根据Na原子结构确定Na的性质,结构决定性质,注意:钠和氧气接触生成氧化钠,但钠燃烧生成过氧化钠,反应物相同条件不同导致产物不同.

练习册系列答案
相关题目
13.下列可逆反应达到平衡后,加压或升高温度可使平衡向逆反应方向移动的是( )
| A. | A2(g)+B2(g)?2AB(g)△H<0 | B. | 4NH3(g)+5O2(g)?4NO(g)+6H2O(g)△H<0 | ||
| C. | W(g)?Z(g)△H<0 | D. | 2SO3(g)?2SO2(g)+O2(g)△H>0 |
10.下列交叉分类法正确的是( )
| A. | 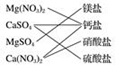 | B. | 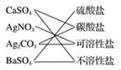 | C. | 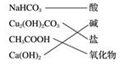 | D. | 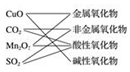 |
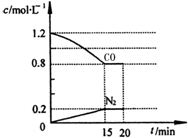 新近出版的《前沿科学》杂志刊发的中国环境科学研究院研究员的论文《汽车尾气污染及其危害》,其中系统地阐述了汽车尾气排放对大气环境及人体健康造成的严重危害.目前降低尾气的可行方法是在汽车排气管上安装催化转化器.NO和CO气体均为汽车尾气的成分,这两种气体在催化转换器中发生反应:2CO(g)+2NO(g)?N2(g)+2CO2(g)△H=-a kJ•mol-1.
新近出版的《前沿科学》杂志刊发的中国环境科学研究院研究员的论文《汽车尾气污染及其危害》,其中系统地阐述了汽车尾气排放对大气环境及人体健康造成的严重危害.目前降低尾气的可行方法是在汽车排气管上安装催化转化器.NO和CO气体均为汽车尾气的成分,这两种气体在催化转换器中发生反应:2CO(g)+2NO(g)?N2(g)+2CO2(g)△H=-a kJ•mol-1.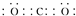 .
.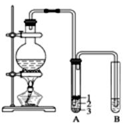 实验室制取少量溴乙烷的装置如图所示.根据题意完成下列填空:
实验室制取少量溴乙烷的装置如图所示.根据题意完成下列填空: 某学习小组拟以下列合成路线合成1-丁醇:
某学习小组拟以下列合成路线合成1-丁醇: