题目内容
17.如图是实验室制备氯气并进行一系列相关实验的装置(夹持设备和A中加热装置已省略).
(1)制备氯气选用的药品为:二氧化锰和浓盐酸,相关反应的化学方程式为:MnO2+4HCl(浓)$\frac{\underline{\;加热\;}}{\;}$MnCl2+Cl2↑+2H2O.
(2)装置B中饱和食盐水的作用是除去Cl2中的HCl;同时装置B亦是安全瓶,监测实验进行时C中是否发生堵塞,请写出发生堵塞时B中的现象B中长颈漏斗中液面上升,形成水柱.
(3)装置F烧杯中盛放的试剂是NaOH溶液,其中发生反应的离子方程式是2OH-+Cl2=Cl-+ClO-+H2O.
(4)装置C的实验目的是验证氯气是否具有漂白性,为此C中Ⅰ、Ⅱ、Ⅲ依次放入D.
| 选项 | Ⅰ | Ⅱ | Ⅲ |
| A | 干燥的有色布条 | 碱石灰 | 湿润的有色布条 |
| B | 干燥的有色布条 | 硅胶 | 湿润的有色布条 |
| C | 湿润的有色布条 | 浓硫酸 | 干燥的有色布条 |
| D | 湿润的有色布条 | 无水氯化钙 | 干燥的有色布条 |
分析 (1)二氧化锰与浓盐酸在加热条件下反应生成氯化锰、氯气和水;
(2)浓盐酸易挥发,制备的氯气中含有氯化氢,氯化氢在饱和食盐水中溶解度较大,氯气在饱和食盐水中溶解度不大;B为安全瓶,监测实验进行时C中是否发生堵塞,发生堵塞时B中的压强增大;
(3)氯气有毒,直接排放容易引起空气污染,氯气能够与氢氧化钠反应,可以用氢氧化钠溶液吸收过量的氯气;
(4)验证氯气是否具有漂白性,要验证干燥氯气无漂白性,湿润的有色布条中,氯气和水反应生成次氯酸具有漂白性;
(5)打开活塞,将装置D中少量溶液加入装置E中,生成的溴单质和碘化钾反应生成碘单质,碘单质溶解于苯中,振荡分层,苯层在上层;过量氯气也会也会碘离子生成碘单质.
解答 解:(1)二氧化锰与浓盐酸在加热条件下反应生成氯化锰、氯气和水,化学方程式:MnO2+4HCl(浓) $\frac{\underline{\;加热\;}}{\;}$MnCl2+Cl2↑+2H2O;
故答案为:MnO2+4HCl(浓) $\frac{\underline{\;加热\;}}{\;}$MnCl2+Cl2↑+2H2O;
(2)制备的氯气中含有氯化氢,氯化氢在饱和食盐水中溶解度较大,氯气在饱和食盐水中溶解度不大,所以可以用B中饱和食盐水吸收氯气中的氯化氢;监测实验进行时C中是否发生堵塞,发生堵塞时B中的,压强增大,气体将溶液压入长颈漏斗B中,形成水柱;
故答案为:除去Cl2中的HCl; B中长颈漏斗中液面上升,形成水柱;
(3)氯气有毒,直接排放容易引起空气污染,氯气能够与氢氧化钠反应生成氯钠、次氯酸钠和水,离子方程式:2OH-+Cl2=Cl-+ClO-+H2O,可以用氢氧化钠溶液吸收过量的氯气;
故答案为:NaOH溶液;2OH-+Cl2=Cl-+ClO-+H2O;
(4)装置C的实验目的是验证氯气是否具有漂白性,验证氯气是否具有漂白性,要验证干燥氯气无漂白性,湿润的有色布条中,氯气和水反应生成次氯酸具有漂白性,选项中AB的Ⅱ中都是干燥剂,再通入湿润的有色布条不能验证氯气的漂白性;C中II为固体干燥剂,不能为浓硫酸,所以C中I、II、III依次放入湿润的有色布条、无水氯化钙、干燥的有色布条,所以选D,
故答案为:D;
(5)打开活塞,将装置D中含溴单质的少量溶液加入焓碘化钾和苯的装置E中,溴单质和碘化钾反应生成碘单质,碘单质溶于苯呈紫红色,振荡.观察到的现象是:E中溶液分为两层,上层(苯层)为紫红色,此现象不能说明溴的氧化性大于碘,因为过量的氯气也会也会碘离子为碘单质;
故答案为:E中溶液分为两层,上层(苯层)为紫红色;不能; 过量的Cl2也可将I-氧化为I2;
点评 本题考查了氯气实验室制取、氯气化学性质、实验装置的理解评价、化学方程式的书写等,注意基础知识的掌握,本题难度中等.

 提分百分百检测卷单元期末测试卷系列答案
提分百分百检测卷单元期末测试卷系列答案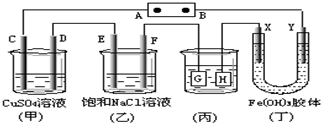 如下图所示的装置,C.D.E.F.X.Y都是惰性电极.将电源接通后,向(乙)中滴入酚酞溶液,在F极附近显红色.则以下说法正确的是( )
如下图所示的装置,C.D.E.F.X.Y都是惰性电极.将电源接通后,向(乙)中滴入酚酞溶液,在F极附近显红色.则以下说法正确的是( )| A. | 电源B极是正极 | |
| B. | 欲用丙装置给铜镀银,H应该是Ag,电镀液是AgNO3溶液 | |
| C. | 甲、乙装置的C、D、E、F电极均有单质生成,其物质的量之比为1:2:2:2 | |
| D. | 装置乙中E极附近产生可燃气体 |
| A. | 溶液因不带电而稳定,胶体因带电而不稳定 | |
| B. | 定容时,因不慎使液面高于容量瓶的刻度线,需重新配制 | |
| C. | 用酒精可以从碘水中萃取碘 | |
| D. | 焰色反应是化学变化 |
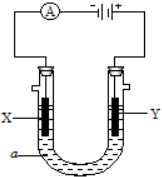 电解原理在化学工业中有广泛应用.如图表示一个电解池,装有电解液a;X、Y是两块电极板,通过导线与直流电源相连.请回答以下问题:
电解原理在化学工业中有广泛应用.如图表示一个电解池,装有电解液a;X、Y是两块电极板,通过导线与直流电源相连.请回答以下问题:

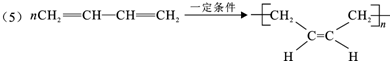 .若H分子中所有碳原子均在一条直线上,则G转化为H的化学方程式为CH3CHBrCHBrCH3+2NaOH$→_{△}^{醇}$H3CC≡CCH3↑+2NaBr+2H2O.
.若H分子中所有碳原子均在一条直线上,则G转化为H的化学方程式为CH3CHBrCHBrCH3+2NaOH$→_{△}^{醇}$H3CC≡CCH3↑+2NaBr+2H2O. .
.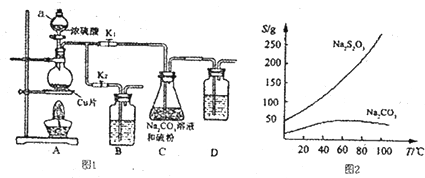
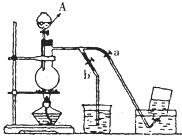 如图表示在没有通风橱的条件下制备氯气时的装置,图中a、b是可控制的弹簧铁夹.(已知:氯气在饱和氯化钠溶液中的溶解度较小.
如图表示在没有通风橱的条件下制备氯气时的装置,图中a、b是可控制的弹簧铁夹.(已知:氯气在饱和氯化钠溶液中的溶解度较小.