题目内容
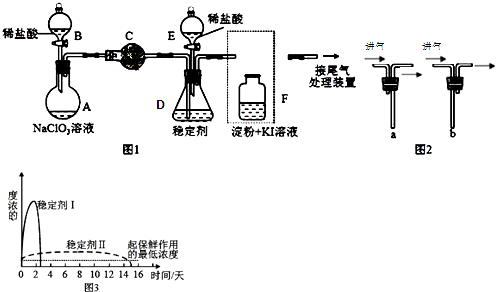
5.如图为实验室制取和收集纯净干燥的氯气,并进行氯气性质探究的实验装置图:(已知:品红是一种红色的有机物)
(1)反应前,在装置A中分液漏斗装浓盐酸(填写仪器名称)
(2)装置B中的现象是溶液变蓝.反应的离子方程式为Cl2+2I-=I2+2Cl-.
(3)装置D中所装试剂是浓硫酸,作用是干燥氯气.
(4)装置F中发生反应的化学方程式为Cl2+2NaOH=NaCl+NaClO+H2O.
分析 (1)依据仪器形状说出其名称;
(2)氯气具有强的氧化性,能够氧化碘离子生成单质碘,碘遇到淀粉变蓝;
(3)氯气通过品红溶液,携带挥发出的水蒸气,要收集干燥氯气,需要除去氯气中水蒸气;
(4)氯气与氢氧化钠溶液反应生成氯化钠、次氯酸钠和水.
解答 解:(1)图中仪器A为分液漏斗,故答案为:分液漏斗;
(2)氯气具有强的氧化性,能够氧化碘离子生成单质碘,离子方程式:Cl2+2I-=I2+2Cl-,碘遇到淀粉变蓝;
故答案为:溶液变蓝;Cl2+2I-=I2+2Cl-;
(3)浓硫酸具有吸水性,可以干燥氯气中的水蒸气,故答案为:浓硫酸;干燥氯气;
(4)氯气与氢氧化钠溶液反应生成氯化钠、次氯酸钠和水,化学方程式:Cl2+2NaOH=NaCl+NaClO+H2O,故答案为:Cl2+2NaOH=NaCl+NaClO+H2O.
点评 本题考查了氯气的制备及氯气性质的检验、收集、尾气处理,明确制备原理及氯气的化学性质是解题关键,题目难度不大.

练习册系列答案
 阳光考场单元测试卷系列答案
阳光考场单元测试卷系列答案 名校联盟冲刺卷系列答案
名校联盟冲刺卷系列答案 名校提分一卷通系列答案
名校提分一卷通系列答案 课程达标测试卷闯关100分系列答案
课程达标测试卷闯关100分系列答案
相关题目
15.以石墨为电极,电解KI溶液(含有少量的酚酞和淀粉),下列说法正确的是( )
| A. | 阳极附近溶液呈红色 | B. | 阳极逸出气体 | ||
| C. | 阴极附近溶液呈蓝色 | D. | 溶液的PH变大 |
16.某原电池的总反应是Zn+Cu2+═Zn2++Cu,则该原电池的组成正确的是( )
| A | B | C | D | |
| 正极 | Zn | Fe | 碳棒 | Cu |
| 负极 | 碳棒 | Zn | Zn | Zn |
| 电解质溶液 | CuCl2 | H2SO4 | CuSO4 | ZnCl2 |
| A. | A | B. | B | C. | C | D. | D |
17.如图是实验室制备氯气并进行一系列相关实验的装置(夹持设备和A中加热装置已省略).

(1)制备氯气选用的药品为:二氧化锰和浓盐酸,相关反应的化学方程式为:MnO2+4HCl(浓)$\frac{\underline{\;加热\;}}{\;}$MnCl2+Cl2↑+2H2O.
(2)装置B中饱和食盐水的作用是除去Cl2中的HCl;同时装置B亦是安全瓶,监测实验进行时C中是否发生堵塞,请写出发生堵塞时B中的现象B中长颈漏斗中液面上升,形成水柱.
(3)装置F烧杯中盛放的试剂是NaOH溶液,其中发生反应的离子方程式是2OH-+Cl2=Cl-+ClO-+H2O.
(4)装置C的实验目的是验证氯气是否具有漂白性,为此C中Ⅰ、Ⅱ、Ⅲ依次放入D.
(5)设计装置D、E的目的是比较Cl2、Br2、I2的氧化性强弱.当向D中缓缓通入足量氯气时,可以看到无色溶液逐渐变为红棕色,说明Cl2的氧化性大于Br2.打开活塞,将装置D中少量溶液加入装置E中,振荡.观察到的现象是E中溶液分为两层,下层(CCl4层)为紫红色.该现象不能(填“能”或“不能”)说明Br2的氧化性强于I2,原因是过量的Cl2也可将I-氧化为I2.

(1)制备氯气选用的药品为:二氧化锰和浓盐酸,相关反应的化学方程式为:MnO2+4HCl(浓)$\frac{\underline{\;加热\;}}{\;}$MnCl2+Cl2↑+2H2O.
(2)装置B中饱和食盐水的作用是除去Cl2中的HCl;同时装置B亦是安全瓶,监测实验进行时C中是否发生堵塞,请写出发生堵塞时B中的现象B中长颈漏斗中液面上升,形成水柱.
(3)装置F烧杯中盛放的试剂是NaOH溶液,其中发生反应的离子方程式是2OH-+Cl2=Cl-+ClO-+H2O.
(4)装置C的实验目的是验证氯气是否具有漂白性,为此C中Ⅰ、Ⅱ、Ⅲ依次放入D.
| 选项 | Ⅰ | Ⅱ | Ⅲ |
| A | 干燥的有色布条 | 碱石灰 | 湿润的有色布条 |
| B | 干燥的有色布条 | 硅胶 | 湿润的有色布条 |
| C | 湿润的有色布条 | 浓硫酸 | 干燥的有色布条 |
| D | 湿润的有色布条 | 无水氯化钙 | 干燥的有色布条 |
14.废弃物的综合利用既有利于节约资源,又有利于保护环境.实验室利用废弃旧电池的铜帽(Zn、Cu总含量约为99%)回收铜并制备ZnO的部分实验过程如图:

(1)为确定加入锌灰(主要成分为Zn、ZnO,杂质为铁及其氧化物)含量,实验中需测定除去H2O2后溶液中Cu2+的含量.实验操作为:准确量取一定体积的含有Cu2+的溶液于带塞锥形瓶中,加适量水稀释,调节pH=3~4,加入过量KI,用Na2S2O3标准溶液滴定至终点.上述过程中的离子方程式如下:2Cu2++4I-═2CuI(白色)↓+I2;I2+2S2O32-═2I-+S4O62-
①Na2S2O3标准溶液应装在碱式(填酸式或碱式)滴定管内.
②滴定选用的指示剂为淀粉溶液,滴定终点观察到的现象为滴加最后一滴,颜色由蓝色变成无色,且半分钟内不变.
③若滴定前溶液中H2O2没有除尽,所测定的Cu2+的含量将会偏高(填“偏高”“偏低”“不变”).
(2)已知pH>11时Zn(OH)2能溶于NaOH溶液生成[Zn(OH)4]2-.下表列出了几种离子生成氢氧化物沉淀pH范围(开始沉淀的pH按金属离子浓度为1.0mol•L-1计算).
实验中可选用的试剂:30% H2O2、1.0mol•L-1HNO3、1.0mol•L-1 NaOH.
由除去铜的滤液制备ZnO的实验步骤依次为:
①加H2O2,氧化Fe2+;
②加氢氧化钠溶液,控制PH在4左右;
③过滤;
④加氢氧化钠溶液,控制PH在8.9-11之间;
⑤过滤、洗涤、干燥
⑥900℃煅烧.

(1)为确定加入锌灰(主要成分为Zn、ZnO,杂质为铁及其氧化物)含量,实验中需测定除去H2O2后溶液中Cu2+的含量.实验操作为:准确量取一定体积的含有Cu2+的溶液于带塞锥形瓶中,加适量水稀释,调节pH=3~4,加入过量KI,用Na2S2O3标准溶液滴定至终点.上述过程中的离子方程式如下:2Cu2++4I-═2CuI(白色)↓+I2;I2+2S2O32-═2I-+S4O62-
①Na2S2O3标准溶液应装在碱式(填酸式或碱式)滴定管内.
②滴定选用的指示剂为淀粉溶液,滴定终点观察到的现象为滴加最后一滴,颜色由蓝色变成无色,且半分钟内不变.
③若滴定前溶液中H2O2没有除尽,所测定的Cu2+的含量将会偏高(填“偏高”“偏低”“不变”).
(2)已知pH>11时Zn(OH)2能溶于NaOH溶液生成[Zn(OH)4]2-.下表列出了几种离子生成氢氧化物沉淀pH范围(开始沉淀的pH按金属离子浓度为1.0mol•L-1计算).
实验中可选用的试剂:30% H2O2、1.0mol•L-1HNO3、1.0mol•L-1 NaOH.
| 开始沉淀的pH | 完全沉淀的pH | |
| Fe3+ | 1.1 | 3.2 |
| Fe2+ | 5.8 | 8.8 |
| Zn2+ | 5.9 | 8.9 |
①加H2O2,氧化Fe2+;
②加氢氧化钠溶液,控制PH在4左右;
③过滤;
④加氢氧化钠溶液,控制PH在8.9-11之间;
⑤过滤、洗涤、干燥
⑥900℃煅烧.
15.常温下,下列各组离子一定能在指定溶液中大量共存的是( )
| A. | 在0.01mol•L-1Ba(OH)2溶液中:Na+、NH4+、NO3-、HCO3- | |
| B. | 使甲基橙变红色的溶液中:Mg2+、Fe2+、NO-3、Cl- | |
| C. | 含有苯酚的溶液中:K+、Cl-、Br-、Fe3+ | |
| D. | 水电离的c(H+)=1×10-13mol•L-1的溶液中:K+、Na+、I-、SO42- |
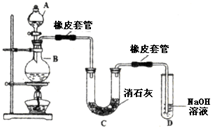 瑞典化学家舍勒在研究软锰矿(主要成分是MnO2)的过程中,将它与浓盐酸混合加热,产生了一种黄绿色、刺激性气味的气体--氯气.某学生使用这一原理设计如图所示的实验装置,并且利用制得的氯气与潮湿的消石灰反应制取少量漂白粉(这是一个放热反应),据此回答下列问题:
瑞典化学家舍勒在研究软锰矿(主要成分是MnO2)的过程中,将它与浓盐酸混合加热,产生了一种黄绿色、刺激性气味的气体--氯气.某学生使用这一原理设计如图所示的实验装置,并且利用制得的氯气与潮湿的消石灰反应制取少量漂白粉(这是一个放热反应),据此回答下列问题: 如图表示在没有通风橱的条件下制备氯气时设计的装置,图中a、b是可控制的弹簧铁夹.(氯气在饱和氯化钠溶液中的溶解度较小.)
如图表示在没有通风橱的条件下制备氯气时设计的装置,图中a、b是可控制的弹簧铁夹.(氯气在饱和氯化钠溶液中的溶解度较小.)