题目内容
7.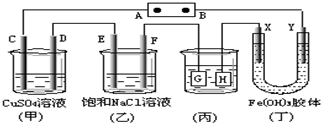 如下图所示的装置,C.D.E.F.X.Y都是惰性电极.将电源接通后,向(乙)中滴入酚酞溶液,在F极附近显红色.则以下说法正确的是( )
如下图所示的装置,C.D.E.F.X.Y都是惰性电极.将电源接通后,向(乙)中滴入酚酞溶液,在F极附近显红色.则以下说法正确的是( )| A. | 电源B极是正极 | |
| B. | 欲用丙装置给铜镀银,H应该是Ag,电镀液是AgNO3溶液 | |
| C. | 甲、乙装置的C、D、E、F电极均有单质生成,其物质的量之比为1:2:2:2 | |
| D. | 装置乙中E极附近产生可燃气体 |
分析 A.根据图片知,该装置是电解池,将电源接通后,向(乙)中滴入酚酞溶液,在F极附近显红色,说明F极上氢离子放电生成氢气,所以F极是阴极,则电源B极是负极,A极是正极;
B.电镀时,镀层作阳极,镀件作阴极,电解质溶液中金属阳离子与阳极材料是相同的元素;
C.甲装置中C电极上氢氧根离子放电,D电极上铜离子放电,E电极上氯离子放电,F电极上氢离子放电,根据得失电子和生成物的关系式计算;
D.在F极附近显红色,说明F极上氢离子放电生成氢气,则E极生成的是氯气.
解答 解:A.根据图片知,该装置是电解池,将电源接通后,向(乙)中滴入酚酞溶液,在F极附近显红色,说明F极附近有大量氢氧根离子,由此得出F极上氢离子放电生成氢气,所以F极是阴极,则电源B极是负极,A极是正极,故A错误;
B.若用(丙)装置给铜镀银,G应该是Ag,H是铜,电镀液是AgNO3溶液,故B错误;
C.甲装置中C电极上氢氧根离子放电生成氧气,D电极上铜离子放电生成铜单质,E电极上氯离子放电生成氯气,F电极上氢离子放电生成氢气,所以(甲)、(乙)装置的C、D、E、F电极均有单质生成;生成1mol氧气需要4mol电子,生成1mol铜时需要2mol电子,生成1mol氯气时需要2mol电子,生成1mol氢气时需要2mol电子,所以转移相同物质的量的电子时生成单质的物质的量之比为1:2:2:2,故C正确;
D.向(乙)中滴入酚酞溶液,在F极附近显红色,说明F极附近有大量氢氧根离子,由此得出F极上氢离子放电生成氢气,则E为阳极,E电极氯离子放电生成氯气,故D错误;
故选C.
点评 本题考查了电解池工作原理,题目难度中等,能正确判断电解池的阴阳极是解本题的关键,注意掌握电解池工作原理及其应用方法,试题培养了学生的分析能力及灵活应用能力.

 轻巧夺冠周测月考直通名校系列答案
轻巧夺冠周测月考直通名校系列答案| A. | 9种 | B. | 16种 | C. | 20种 | D. | 29种 |
| A. | 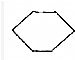 和 和 | B. | 金刚石和石墨 | ||
| C. | H3C-O-CH3和CH3CH2OH | D. |  和 和 |
| A. | 阳极附近溶液呈红色 | B. | 阳极逸出气体 | ||
| C. | 阴极附近溶液呈蓝色 | D. | 溶液的PH变大 |
| A | B | C | D | |
| 正极 | Zn | Fe | 碳棒 | Cu |
| 负极 | 碳棒 | Zn | Zn | Zn |
| 电解质溶液 | CuCl2 | H2SO4 | CuSO4 | ZnCl2 |
| A. | A | B. | B | C. | C | D. | D |

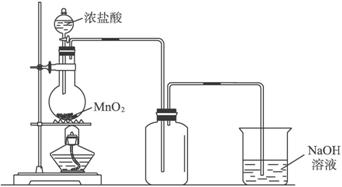
(1)制备氯气选用的药品为:二氧化锰和浓盐酸,相关反应的化学方程式为:MnO2+4HCl(浓)$\frac{\underline{\;加热\;}}{\;}$MnCl2+Cl2↑+2H2O.
(2)装置B中饱和食盐水的作用是除去Cl2中的HCl;同时装置B亦是安全瓶,监测实验进行时C中是否发生堵塞,请写出发生堵塞时B中的现象B中长颈漏斗中液面上升,形成水柱.
(3)装置F烧杯中盛放的试剂是NaOH溶液,其中发生反应的离子方程式是2OH-+Cl2=Cl-+ClO-+H2O.
(4)装置C的实验目的是验证氯气是否具有漂白性,为此C中Ⅰ、Ⅱ、Ⅲ依次放入D.
| 选项 | Ⅰ | Ⅱ | Ⅲ |
| A | 干燥的有色布条 | 碱石灰 | 湿润的有色布条 |
| B | 干燥的有色布条 | 硅胶 | 湿润的有色布条 |
| C | 湿润的有色布条 | 浓硫酸 | 干燥的有色布条 |
| D | 湿润的有色布条 | 无水氯化钙 | 干燥的有色布条 |
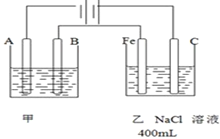
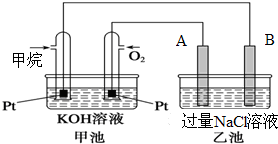 如图所示是甲烷燃料电池工作时的装置,乙池中的两个电极一个是石墨电极,一个是铜电极,工作时A、B两个电极的质量都不减少,请回答下列问题:
如图所示是甲烷燃料电池工作时的装置,乙池中的两个电极一个是石墨电极,一个是铜电极,工作时A、B两个电极的质量都不减少,请回答下列问题: