题目内容
6.下列有关叙述正确的是( )| A. | 溶液因不带电而稳定,胶体因带电而不稳定 | |
| B. | 定容时,因不慎使液面高于容量瓶的刻度线,需重新配制 | |
| C. | 用酒精可以从碘水中萃取碘 | |
| D. | 焰色反应是化学变化 |
分析 A.溶液和胶体都是中性分散系;
B.定容时,因不慎使液面高于容量的刻度线,要重新配置;
C.萃取剂不能与水混溶;
D.焰色反应属于物理性质.
解答 解:A.溶液和胶体都是中性分散系,溶液是稳定分散系,胶体是较稳定分散系,故A错误;
B.定容时,因不慎使液面高于容量的刻度线,如果滴管将多余液体吸出会导致溶质物质的量减少,所以配制溶液浓度偏低,则要重新配置,故B正确;
C.酒精与水混溶,不能分离碘和水,不能用作萃取剂,故C错误;
D.焰色反应属于元素的物理性质,产生焰色反应时没有新物质生成,不是化学变化,故D错误.
故选B.
点评 本题考查物质的分离、提纯和焰色反应等知识,为高频考点,侧重学生的分析、实验能力的考查,注意把握物质的性质的异同,为解答该题的关键,难度不大.

练习册系列答案
相关题目
16.某原电池的总反应是Zn+Cu2+═Zn2++Cu,则该原电池的组成正确的是( )
| A | B | C | D | |
| 正极 | Zn | Fe | 碳棒 | Cu |
| 负极 | 碳棒 | Zn | Zn | Zn |
| 电解质溶液 | CuCl2 | H2SO4 | CuSO4 | ZnCl2 |
| A. | A | B. | B | C. | C | D. | D |
17.如图是实验室制备氯气并进行一系列相关实验的装置(夹持设备和A中加热装置已省略).

(1)制备氯气选用的药品为:二氧化锰和浓盐酸,相关反应的化学方程式为:MnO2+4HCl(浓)$\frac{\underline{\;加热\;}}{\;}$MnCl2+Cl2↑+2H2O.
(2)装置B中饱和食盐水的作用是除去Cl2中的HCl;同时装置B亦是安全瓶,监测实验进行时C中是否发生堵塞,请写出发生堵塞时B中的现象B中长颈漏斗中液面上升,形成水柱.
(3)装置F烧杯中盛放的试剂是NaOH溶液,其中发生反应的离子方程式是2OH-+Cl2=Cl-+ClO-+H2O.
(4)装置C的实验目的是验证氯气是否具有漂白性,为此C中Ⅰ、Ⅱ、Ⅲ依次放入D.
(5)设计装置D、E的目的是比较Cl2、Br2、I2的氧化性强弱.当向D中缓缓通入足量氯气时,可以看到无色溶液逐渐变为红棕色,说明Cl2的氧化性大于Br2.打开活塞,将装置D中少量溶液加入装置E中,振荡.观察到的现象是E中溶液分为两层,下层(CCl4层)为紫红色.该现象不能(填“能”或“不能”)说明Br2的氧化性强于I2,原因是过量的Cl2也可将I-氧化为I2.

(1)制备氯气选用的药品为:二氧化锰和浓盐酸,相关反应的化学方程式为:MnO2+4HCl(浓)$\frac{\underline{\;加热\;}}{\;}$MnCl2+Cl2↑+2H2O.
(2)装置B中饱和食盐水的作用是除去Cl2中的HCl;同时装置B亦是安全瓶,监测实验进行时C中是否发生堵塞,请写出发生堵塞时B中的现象B中长颈漏斗中液面上升,形成水柱.
(3)装置F烧杯中盛放的试剂是NaOH溶液,其中发生反应的离子方程式是2OH-+Cl2=Cl-+ClO-+H2O.
(4)装置C的实验目的是验证氯气是否具有漂白性,为此C中Ⅰ、Ⅱ、Ⅲ依次放入D.
| 选项 | Ⅰ | Ⅱ | Ⅲ |
| A | 干燥的有色布条 | 碱石灰 | 湿润的有色布条 |
| B | 干燥的有色布条 | 硅胶 | 湿润的有色布条 |
| C | 湿润的有色布条 | 浓硫酸 | 干燥的有色布条 |
| D | 湿润的有色布条 | 无水氯化钙 | 干燥的有色布条 |
14.废弃物的综合利用既有利于节约资源,又有利于保护环境.实验室利用废弃旧电池的铜帽(Zn、Cu总含量约为99%)回收铜并制备ZnO的部分实验过程如图:
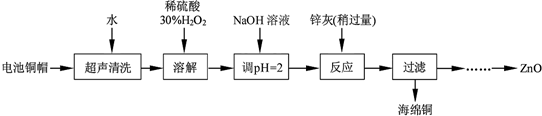
(1)为确定加入锌灰(主要成分为Zn、ZnO,杂质为铁及其氧化物)含量,实验中需测定除去H2O2后溶液中Cu2+的含量.实验操作为:准确量取一定体积的含有Cu2+的溶液于带塞锥形瓶中,加适量水稀释,调节pH=3~4,加入过量KI,用Na2S2O3标准溶液滴定至终点.上述过程中的离子方程式如下:2Cu2++4I-═2CuI(白色)↓+I2;I2+2S2O32-═2I-+S4O62-
①Na2S2O3标准溶液应装在碱式(填酸式或碱式)滴定管内.
②滴定选用的指示剂为淀粉溶液,滴定终点观察到的现象为滴加最后一滴,颜色由蓝色变成无色,且半分钟内不变.
③若滴定前溶液中H2O2没有除尽,所测定的Cu2+的含量将会偏高(填“偏高”“偏低”“不变”).
(2)已知pH>11时Zn(OH)2能溶于NaOH溶液生成[Zn(OH)4]2-.下表列出了几种离子生成氢氧化物沉淀pH范围(开始沉淀的pH按金属离子浓度为1.0mol•L-1计算).
实验中可选用的试剂:30% H2O2、1.0mol•L-1HNO3、1.0mol•L-1 NaOH.
由除去铜的滤液制备ZnO的实验步骤依次为:
①加H2O2,氧化Fe2+;
②加氢氧化钠溶液,控制PH在4左右;
③过滤;
④加氢氧化钠溶液,控制PH在8.9-11之间;
⑤过滤、洗涤、干燥
⑥900℃煅烧.

(1)为确定加入锌灰(主要成分为Zn、ZnO,杂质为铁及其氧化物)含量,实验中需测定除去H2O2后溶液中Cu2+的含量.实验操作为:准确量取一定体积的含有Cu2+的溶液于带塞锥形瓶中,加适量水稀释,调节pH=3~4,加入过量KI,用Na2S2O3标准溶液滴定至终点.上述过程中的离子方程式如下:2Cu2++4I-═2CuI(白色)↓+I2;I2+2S2O32-═2I-+S4O62-
①Na2S2O3标准溶液应装在碱式(填酸式或碱式)滴定管内.
②滴定选用的指示剂为淀粉溶液,滴定终点观察到的现象为滴加最后一滴,颜色由蓝色变成无色,且半分钟内不变.
③若滴定前溶液中H2O2没有除尽,所测定的Cu2+的含量将会偏高(填“偏高”“偏低”“不变”).
(2)已知pH>11时Zn(OH)2能溶于NaOH溶液生成[Zn(OH)4]2-.下表列出了几种离子生成氢氧化物沉淀pH范围(开始沉淀的pH按金属离子浓度为1.0mol•L-1计算).
实验中可选用的试剂:30% H2O2、1.0mol•L-1HNO3、1.0mol•L-1 NaOH.
| 开始沉淀的pH | 完全沉淀的pH | |
| Fe3+ | 1.1 | 3.2 |
| Fe2+ | 5.8 | 8.8 |
| Zn2+ | 5.9 | 8.9 |
①加H2O2,氧化Fe2+;
②加氢氧化钠溶液,控制PH在4左右;
③过滤;
④加氢氧化钠溶液,控制PH在8.9-11之间;
⑤过滤、洗涤、干燥
⑥900℃煅烧.
1.下列叙述正确的是( )
| A. | 合金中至少含有两种金属 | |
| B. | 漂白粉能在空气中长期存放 | |
| C. | 工艺师利用氢氟酸刻蚀石英制作艺术品 | |
| D. | NaOH溶液保存在配有磨口玻璃塞的细口试剂瓶中 |
11.向一定量FeO、Fe、Fe3O4的混合物中加入200mL1mol/L的盐酸,恰好使混合物完全溶解,并放出224mL(标准状况)气体,所得溶液经检验不含Fe3+.若用足量CO在高温下还原相同质量的此混合物,能得到铁的质量是( )
| A. | 11.2g | B. | 5.6g | C. | 2.8g | D. | 无法计算 |
15.常温下,下列各组离子一定能在指定溶液中大量共存的是( )
| A. | 在0.01mol•L-1Ba(OH)2溶液中:Na+、NH4+、NO3-、HCO3- | |
| B. | 使甲基橙变红色的溶液中:Mg2+、Fe2+、NO-3、Cl- | |
| C. | 含有苯酚的溶液中:K+、Cl-、Br-、Fe3+ | |
| D. | 水电离的c(H+)=1×10-13mol•L-1的溶液中:K+、Na+、I-、SO42- |
16.化学反应是化学实验现象的本质,根据描述回答下列问题:
(1)在BaCl2溶液中通入SO2气体,未见沉淀生成,若先通入或加入下列的另一种物质,再通入SO2不能看到沉淀的有③⑤(填序号).
①Cl2②NaOH③HCl④FeCl3溶液⑤CO2⑥H2S⑦NH3⑧NaClO溶液
(2)图中A、B、C之间有以下的转化关系(副产物已略去);

则下列说法正确的是abc
a.若A是非金属单质,则C与水反应的生成物可能是强酸或弱酸
b.若A是金属单质,则C与水反应的生成物可能是强碱
c.若A是化合物,则C与水反应的生成物可能是强酸
(3)离子方程式是重要的化学用语.下列是有关离子方程式的一些错误观点,请在下列表格相应的“离子方程式”否定这些观点.
反应物从下列物质中选取:Na、Fe、H2O、H2SO4、HCl、NaOH、Ba(OH)2、CuSO4
(1)在BaCl2溶液中通入SO2气体,未见沉淀生成,若先通入或加入下列的另一种物质,再通入SO2不能看到沉淀的有③⑤(填序号).
①Cl2②NaOH③HCl④FeCl3溶液⑤CO2⑥H2S⑦NH3⑧NaClO溶液
(2)图中A、B、C之间有以下的转化关系(副产物已略去);

则下列说法正确的是abc
a.若A是非金属单质,则C与水反应的生成物可能是强酸或弱酸
b.若A是金属单质,则C与水反应的生成物可能是强碱
c.若A是化合物,则C与水反应的生成物可能是强酸
(3)离子方程式是重要的化学用语.下列是有关离子方程式的一些错误观点,请在下列表格相应的“离子方程式”否定这些观点.
反应物从下列物质中选取:Na、Fe、H2O、H2SO4、HCl、NaOH、Ba(OH)2、CuSO4
| 错误观点 | “否定的”离子方程式 | |
| ① | 所有的离子方程式均可以表示一类化学反应 | 2Na+2H2O=2Na++2OH-+H2↑ |
| ② | 所有酸碱中和反应均可表示为 H++OH-═H2O | 2H++SO42-+Ba2++2OH-=BaSO4↓+2H2O |