题目内容
5.下表是元素周期表的一部分.| 族 周期 | IA | IIA | IIIA | IVA | VA | VIA | VIIA |
| 1 | ① | ||||||
| 2 | ② | ③ | ④ | ||||
| 3 | ⑤ | ⑥ | ⑦ | ⑧ |
(2)在这些元素的最高价氧化物对应的水化物中,酸性最强的是HClO4,碱性最强的是NaOH,(填化学式)
(3)表中元素③的氢化物的化学式为NH3,此氢化物的稳定性比元素⑦的氢化物的稳定性强(填“强”或“弱”)
(4)①与②形成的一种化合物是沼气的主要成分,该化合物的电子式为
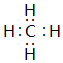
(5)⑥元素最高价氧化物对应的水化物的化学式为Al(OH)3,该物质不能(填“能”或“不能”)溶于氨水,在水中的电离方程式为AlO2-+H++H2O?Al(OH)3?Al3++3OH-.该物质与NaOH溶液反应时的离子方程式为Al(OH)3+OH-=AlO2-+H2O.
(6)⑤、⑥两元素相比较,金属性较强是Na(填元素符号),可以验证该结论的实验是AC
A、比较这两种元素最高价氧化物对应的水化物的碱性
B、比较这两种元素的气态氢化物的稳定性
C、将这两种元素的单质分别放入冷水中
D、比较这两种元素的单质与酸反应时失电子的数目.
分析 由元素在周期表中的位置可知,①为H,②为C,③为N,④为O,⑤为Na,⑥为Al,⑦为P,⑧为Cl.
(1)同周期自左而右原子半径碱性;
(2)非金属性越强,最高价含氧酸的酸性越强;金属性越强,最高价氧化物对应水化物的碱性越强;
(3)非金属性越强,氢化物越稳定;
(4)①与②形成的一种化合物是沼气的主要成分,该化合物为CH4;
(5)⑥元素最高价氧化物对应的水化物为氢氧化铝,不能溶于弱碱性的氨水,在水中存在酸式电离、碱式电离两种情况,氢氧化铝与氢氧化钠反应生成偏铝酸钠与水;
(6)同周期自左而右金属性减弱,
金属性强弱与失去电子难易程度有关,与失去电子数目无关,可以根据金属与水或的难易程度、剧烈程度判断,或者根据最高价氧化物对应的水化物的碱性强弱、单质之间相互置换反应等判断.
解答 解:由元素在周期表中的位置可知,①为H,②为C,③为N,④为O,⑤为Na,⑥为Al,⑦为P,⑧为Cl.
(1)同周期自左而右原子半径碱性,故原子半径:C>N>O,
故答案为:C>N>O;
(2)最高价含氧酸的酸性最强的为HClO4,Na的金属性最强,最高价氧化物对应水化物的碱性是NaOH,
故答案为:HClO4;NaOH;
(3)元素③的氢化物的化学式为NH3,由于非金属性N>P,故氢化物稳定性:NH3>PH3,
故答案为:NH3;强;
(4)①与②形成的一种化合物是沼气的主要成分,该化合物为CH4,其电子式为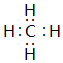 ,
,
故答案为: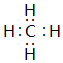 ;
;
(5)⑥元素最高价氧化物对应的水化物为Al(OH)3,不能溶于弱碱性的氨水,在水中电离方程式为:AlO2-+H++H2O?Al(OH)3?Al3++3OH-,氢氧化铝与氢氧化钠反应生成偏铝酸钠与水,反应离子方程式为:Al(OH)3+OH-=AlO2-+H2O,
故答案为:Al(OH)3;不能;AlO2-+H++H2O?Al(OH)3?Al3++3OH-;Al(OH)3+OH-=AlO2-+H2O;
(6)同周期自左而右金属性减弱,故Na的金属性比Al的强,
A、金属性越强,最高价氧化物对应的水化物的碱性越强,故A正确;
B、不能根据金属氢化物稳定性比较金属性强弱,利用氢化物稳定性可以比较元素非金属性强弱,故B错误;
C、单质与冷水反应越剧烈,则金属性越强,故C正确;
将这两种元素的单质分别放入冷水中
D、金属性强弱与失去电子难易程度有关,与失去电子数目无关,故D错误,
故答案为:Na;AC.
点评 本题考查元素周期表与元素周期律综合应用,侧重对元素周期律与化学用语的考查,掌握金属性、非金属性强弱比较实验事实,理解元素周期律.

| A. | 苯是无色无味的液态径,不易燃烧 | |
| B. | 苯与浓硝酸、浓硫酸混合共热可制取硝基苯 | |
| C. | 溴水能与苯发生加成反应而褪色 | |
| D. | 在一定条件下苯与氢气反应制取环己烷,说明苯分子结构中有碳碳双键 |
| A. | 氯化氢能使湿润的蓝色石蕊试纸变为红色,是因为HCl分子中含有H+ | |
| B. | 氯化氢极易溶于水,常温常压下1体积水可溶解500体积HCl | |
| C. | 氯化氢可以用向上排空气法收集 | |
| D. | 氯化氢和盐酸的化学式都是HCl |
| 族 周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0 |
| 2 | ⑤ | ⑦ | ||||||
| 3 | ① | ③ | ④ | ⑥ | ⑧ | ⑨ | ⑩ | |
| 4 | ② |
 .
.(2)形成化合物种类最多的元素是C(填元素符号),其稳定氧化物的结构式为O=C=O.
(3)⑤、⑥、⑦、⑧四种元素所对应的气态氢化物最稳定的是H2O,最不稳定的是SiH4(均填化学式).
(4)以上第三周期元素中的最高价氧化物对应的水化物中,碱性最强的是NaOH(填化学式),呈两性的是Al(OH)3(填化学式),二者发生反应的离子方程式为Al(OH)3+OH-=AlO2-+2H2O.
(5)①、②、③的原子半径由大到小的顺序为K>Na>Mg(填元素符号).
(6)⑦元素的氢化物在常温下与①发生反应的化学方程式为2Na+2H2O=2NaOH+H2↑.
(7)③、④两元素相比较,金属性较强的是Mg(填元素符号),可以验证该结论的方法有ACD(填编号).
A.将这两种元素的块状单质分别放入热水中看与水反应的剧烈程度
B.比较二者与某非金属反应时失电子数目多少
C.比较二者的最高价氧化物的水化物碱性强弱
D.看形状、大小相同的这两种元素的单质分别和同浓度的盐酸反应的剧烈程度.

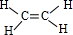
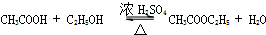 .
.