题目内容
14.下列有关实验装置能达到实验目的是( )| 选项 | A | B | C | D |
| 实验装置 |  | 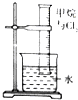 | 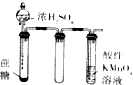 | 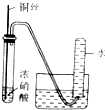 |
| 实验目的 | 提取苯中的Br2 | 探究甲烷的取代反应 | 检验浓硫酸的脱水性和强氧性 | 实验室制备并收集NO2 |
| A. | A | B. | B | C. | C | D. | D |
分析 A.溴与氢氧化钠溶液反应;
B.应用饱和食盐水代替水;
C.浓硫酸可使蔗糖碳化,并生成二氧化硫气体;
D.二氧化氮与水反应,且溶于水.
解答 解:A.溴与氢氧化钠溶液反应,分离溴与苯,应用蒸馏的方法,故A错误;
B.氯气难溶于饱和食盐水,应用饱和食盐水代替水,故B错误;
C.浓硫酸可使蔗糖碳化,表现硫酸的脱水性,并生成二氧化硫气体,表现浓硫酸的强氧化性,故C正确;
D.二氧化氮与水反应,且溶于水,不能用排水法收集,故D错误.
故选C.
点评 本题考查化学实验方案的评价,为高频考点,涉及物质的分离、气体的制备及收集等,侧重实验基本操作和实验技能的考查,注意实验操作的评价性分析,题目难度不大

练习册系列答案
相关题目
5.下表是元素周期表的一部分.
(1)②、③、④三种元素的原子半径从大到小的顺序是C>N>O(用元素符号表示)
(2)在这些元素的最高价氧化物对应的水化物中,酸性最强的是HClO4,碱性最强的是NaOH,(填化学式)
(3)表中元素③的氢化物的化学式为NH3,此氢化物的稳定性比元素⑦的氢化物的稳定性强(填“强”或“弱”)
(4)①与②形成的一种化合物是沼气的主要成分,该化合物的电子式为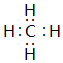
(5)⑥元素最高价氧化物对应的水化物的化学式为Al(OH)3,该物质不能(填“能”或“不能”)溶于氨水,在水中的电离方程式为AlO2-+H++H2O?Al(OH)3?Al3++3OH-.该物质与NaOH溶液反应时的离子方程式为Al(OH)3+OH-=AlO2-+H2O.
(6)⑤、⑥两元素相比较,金属性较强是Na(填元素符号),可以验证该结论的实验是AC
A、比较这两种元素最高价氧化物对应的水化物的碱性
B、比较这两种元素的气态氢化物的稳定性
C、将这两种元素的单质分别放入冷水中
D、比较这两种元素的单质与酸反应时失电子的数目.
| 族 周期 | IA | IIA | IIIA | IVA | VA | VIA | VIIA |
| 1 | ① | ||||||
| 2 | ② | ③ | ④ | ||||
| 3 | ⑤ | ⑥ | ⑦ | ⑧ |
(2)在这些元素的最高价氧化物对应的水化物中,酸性最强的是HClO4,碱性最强的是NaOH,(填化学式)
(3)表中元素③的氢化物的化学式为NH3,此氢化物的稳定性比元素⑦的氢化物的稳定性强(填“强”或“弱”)
(4)①与②形成的一种化合物是沼气的主要成分,该化合物的电子式为
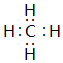
(5)⑥元素最高价氧化物对应的水化物的化学式为Al(OH)3,该物质不能(填“能”或“不能”)溶于氨水,在水中的电离方程式为AlO2-+H++H2O?Al(OH)3?Al3++3OH-.该物质与NaOH溶液反应时的离子方程式为Al(OH)3+OH-=AlO2-+H2O.
(6)⑤、⑥两元素相比较,金属性较强是Na(填元素符号),可以验证该结论的实验是AC
A、比较这两种元素最高价氧化物对应的水化物的碱性
B、比较这两种元素的气态氢化物的稳定性
C、将这两种元素的单质分别放入冷水中
D、比较这两种元素的单质与酸反应时失电子的数目.
9.下列事实能用勒夏特列原理解释的是( )
| A. | 在合成氨的工业生产中,使用较高温度有利于提高产量 | |
| B. | 在合成氨的工业生产中,加压有利于提高氨的产量 | |
| C. | 木炭粉碎后与O2反应,速率更快 | |
| D. | 由H2(g)、I2(g)、HI气体组成的平衡体系加压后颜色变深 |
6.以下几个热化学方程式,能表示固态碳和气态氢气燃烧时的燃烧热的热化学方程式是( )
| A. | C(s)+$\frac{1}{2}$O2(g)═CO(g)△H=+110.5 kJ•mol-1 | |
| B. | C(s)+O2(g)═CO2(g)△H=-393.5 kJ•mol-1 | |
| C. | 2H2(g)+O2(g)═2H2O(l)△H=-571.6 kJ•mol-1 | |
| D. | H2(g)+$\frac{1}{2}$O2(g)═H2O(g)△H=-241.8 kJ•mol-1 |
3..室温时,下列各组中的物质分别与过量NaOH溶液反应,能生成5种盐的是( )
| A. | Al2O3、SO2、CO2、SO3 | B. | CO2、Cl2、CaO、SO3 | ||
| C. | Cl2、Al2O3、SO2、SO3 | D. | SiO2、CO2、CO、Cl2 |
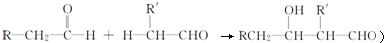 )
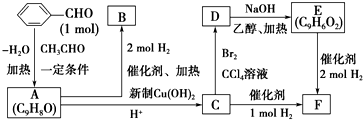
)
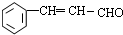 、
、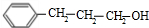 、
、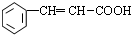 、
、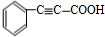 、
、 .
.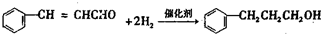 ;
;