题目内容
13.下列各组热化学方程式中,化学反应的△H前者大于后者的是( )①C(s)+O2(g)=CO2(g)△H1;C(s)+$\frac{1}{2}$O2(g)=CO(g)△H2
②S(s)+O2(g)=SO2(g)△H3;S(g)+O2(g)=SO2(g)△H4
③H2(g)+$\frac{1}{2}$O2(g)=H2O(l)△H5;2H2(g)+O2(g)=2H2O(l)△H6
④CaCO3(s)=CaO(s)+CO2(g)△H7;CaO(s)+H2O(l)=Ca(OH)2(s)△H8.
| A. | ②③④ | B. | ④ | C. | ① | D. | ①②③ |
分析 ①②③为放热反应,物质发生化学反应时,生成液态水比生成气态水放出的热量多,反应越完全,放出的热量越多;
④中前者为吸热反应,后者为放热反应,吸热反应△H>0,放热反应△H<0,以此解答该题.
解答 解:①两个反应都为放热反应,△H<0,前者完全反应,放出的热量多,则△H1<△H2,故①错误;
②都为放热反应,其△H<0,前者S为固态,则前者放出的热量少,则△H3>△H4,故②正确;
③都是放热反应,前者反应物系数较小,则前者放出热量较少,则△H5>△H6,故③正确;
④前者为吸热反应,△H7>0,后者为放热反应,△H8<0,则△H7>△H8,故④正确;
根据分析可知,反应的△H前者大于后者的是②③④,
故选A.
点评 本题考查反应热的大小比较,题目难度中等,注意从物质反应的程度以及物质的聚集状态的角度比较反应热的大小,注意放热反应中,放出热量越大,焓变越小,为易错点.

练习册系列答案
 英才计划同步课时高效训练系列答案
英才计划同步课时高效训练系列答案
相关题目
5.下表是元素周期表的一部分.
(1)②、③、④三种元素的原子半径从大到小的顺序是C>N>O(用元素符号表示)
(2)在这些元素的最高价氧化物对应的水化物中,酸性最强的是HClO4,碱性最强的是NaOH,(填化学式)
(3)表中元素③的氢化物的化学式为NH3,此氢化物的稳定性比元素⑦的氢化物的稳定性强(填“强”或“弱”)
(4)①与②形成的一种化合物是沼气的主要成分,该化合物的电子式为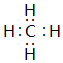
(5)⑥元素最高价氧化物对应的水化物的化学式为Al(OH)3,该物质不能(填“能”或“不能”)溶于氨水,在水中的电离方程式为AlO2-+H++H2O?Al(OH)3?Al3++3OH-.该物质与NaOH溶液反应时的离子方程式为Al(OH)3+OH-=AlO2-+H2O.
(6)⑤、⑥两元素相比较,金属性较强是Na(填元素符号),可以验证该结论的实验是AC
A、比较这两种元素最高价氧化物对应的水化物的碱性
B、比较这两种元素的气态氢化物的稳定性
C、将这两种元素的单质分别放入冷水中
D、比较这两种元素的单质与酸反应时失电子的数目.
| 族 周期 | IA | IIA | IIIA | IVA | VA | VIA | VIIA |
| 1 | ① | ||||||
| 2 | ② | ③ | ④ | ||||
| 3 | ⑤ | ⑥ | ⑦ | ⑧ |
(2)在这些元素的最高价氧化物对应的水化物中,酸性最强的是HClO4,碱性最强的是NaOH,(填化学式)
(3)表中元素③的氢化物的化学式为NH3,此氢化物的稳定性比元素⑦的氢化物的稳定性强(填“强”或“弱”)
(4)①与②形成的一种化合物是沼气的主要成分,该化合物的电子式为
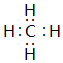
(5)⑥元素最高价氧化物对应的水化物的化学式为Al(OH)3,该物质不能(填“能”或“不能”)溶于氨水,在水中的电离方程式为AlO2-+H++H2O?Al(OH)3?Al3++3OH-.该物质与NaOH溶液反应时的离子方程式为Al(OH)3+OH-=AlO2-+H2O.
(6)⑤、⑥两元素相比较,金属性较强是Na(填元素符号),可以验证该结论的实验是AC
A、比较这两种元素最高价氧化物对应的水化物的碱性
B、比较这两种元素的气态氢化物的稳定性
C、将这两种元素的单质分别放入冷水中
D、比较这两种元素的单质与酸反应时失电子的数目.
3..室温时,下列各组中的物质分别与过量NaOH溶液反应,能生成5种盐的是( )
| A. | Al2O3、SO2、CO2、SO3 | B. | CO2、Cl2、CaO、SO3 | ||
| C. | Cl2、Al2O3、SO2、SO3 | D. | SiO2、CO2、CO、Cl2 |
 ;1mol O22+中含有的π键数目为2NA.
;1mol O22+中含有的π键数目为2NA. 此烃名称为4-甲基-1-戊炔.
此烃名称为4-甲基-1-戊炔. 的烃可命名为1-甲基-3-乙基苯.
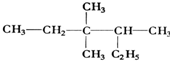
的烃可命名为1-甲基-3-乙基苯. 的烃可命名为:2,4-二甲基-3-乙基戊烷.
的烃可命名为:2,4-二甲基-3-乙基戊烷. 的键线式:
的键线式: .
. 的键线式:
的键线式: .
. 3,3,4-三甲基己烷
3,3,4-三甲基己烷 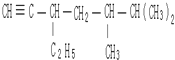 5,6-二甲基-3-乙基-1-庚炔
5,6-二甲基-3-乙基-1-庚炔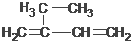 2-乙基-1,3-丁二烯
2-乙基-1,3-丁二烯 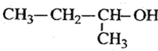 2-丁醇
2-丁醇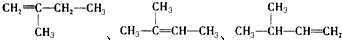 .
.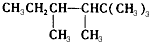 ,若A是单烯烃与氢气加成后的产物.则该单烯烃可能有5种结构.
,若A是单烯烃与氢气加成后的产物.则该单烯烃可能有5种结构.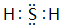 .
.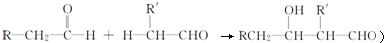 )
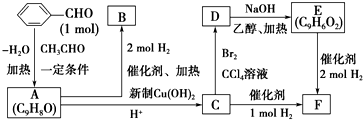
)
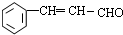 、
、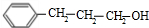 、
、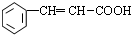 、
、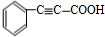 、
、 .
.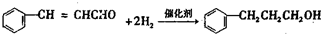 ;
;