题目内容
20.元素周期表与元素周期律在学习、研究和生产实践中有很重要的作用.下表列出了十种元素在周期表中的位置,用化学用语回答下列问题:| 族 周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0 |
| 2 | ⑤ | ⑦ | ||||||
| 3 | ① | ③ | ④ | ⑥ | ⑧ | ⑨ | ⑩ | |
| 4 | ② |
 .
.(2)形成化合物种类最多的元素是C(填元素符号),其稳定氧化物的结构式为O=C=O.
(3)⑤、⑥、⑦、⑧四种元素所对应的气态氢化物最稳定的是H2O,最不稳定的是SiH4(均填化学式).
(4)以上第三周期元素中的最高价氧化物对应的水化物中,碱性最强的是NaOH(填化学式),呈两性的是Al(OH)3(填化学式),二者发生反应的离子方程式为Al(OH)3+OH-=AlO2-+2H2O.
(5)①、②、③的原子半径由大到小的顺序为K>Na>Mg(填元素符号).
(6)⑦元素的氢化物在常温下与①发生反应的化学方程式为2Na+2H2O=2NaOH+H2↑.
(7)③、④两元素相比较,金属性较强的是Mg(填元素符号),可以验证该结论的方法有ACD(填编号).
A.将这两种元素的块状单质分别放入热水中看与水反应的剧烈程度
B.比较二者与某非金属反应时失电子数目多少
C.比较二者的最高价氧化物的水化物碱性强弱
D.看形状、大小相同的这两种元素的单质分别和同浓度的盐酸反应的剧烈程度.
分析 由元素在周期表中位置,可知①为Na、②为K、③为Mg、④为Al、⑤为C、⑥为Al、⑦为O、⑧为P、⑨为Cl、⑩为Ar.
(1)稀有气体Ar原子最外层为稳定结构,化学性质最不活泼;
(2)碳元素形成有机物,是形成化合物种类最多的元素,其稳定氧化物为二氧化碳;
(3)非金属性越强,对应氢化物越稳定;
(4)第三周期中Na的金属性最强,故碱性最强的是NaOH,呈两性的是氢氧化铝,二者反应生成偏铝酸钾与水;
(5)同周期自左而右原子半径减小、同主族自上而下原子半径增大;
(6)⑦元素的氢化物在常温下与①发生反应,应是水与钠反应生成氢氧化钠与氢气;
(7)同周期自左而右金属性减弱,可以根据金属与水或酸反应难易程度、剧烈程度判断,或者根据最高价氧化物对应水化物的碱性强弱、单质之间相互置换反应等判断,金属性强弱与失去电子难易程度有关,与失去电子数目多少无关.
解答 解:由元素在周期表中位置,可知①为Na、②为K、③为Mg、④为Al、⑤为C、⑥为Al、⑦为O、⑧为P、⑨为Cl、⑩为Ar.
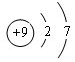
(1)稀有气体Ar原子最外层为稳定结构,化学性质最不活泼,Ar原子核外电子数为18,其原子结构示意图为: ,
,
故答案为: ;
;
(2)碳元素形成有机物,是形成化合物种类最多的元素,其稳定氧化物为二氧化碳,结构简式为O=C=O,
故答案为:C;O=C=O;
(3)同周期自左而右非金属性增强,同主族自上而下非金属性减弱,故四种元素中O的非金属性最强、Si的非金属性最弱,而氢化物稳定性与元素非金属性一致,故H2O最稳定、SiH4最不稳定,
故答案为:H2O;SiH4;
(4)第三周期中Na的金属性最强,故碱性最强的是NaOH,呈两性的是Al(OH)3,二者反应生成偏铝酸钠与水,化学反应离子方程式为:Al(OH)3+OH-=AlO2-+2H2O,
故答案为:NaOH;Al(OH)3;Al(OH)3+OH-=AlO2-+2H2O;
(5)同周期自左而右原子半径减小、同主族自上而下原子半径增大,故离子半径:K>Na>Mg,
故答案为:K>Na>Mg;
(6)⑦元素的氢化物在常温下与①发生反应,应是水与钠反应生成氢氧化钠与氢气,化学反应方程式为:2Na+2H2O=2NaOH+H2↑,
故答案为:2Na+2H2O=2NaOH+H2↑;
(7)同周期自左而右金属性减弱,故Mg的金属性比Al的强,
A.金属性越强,单质与水反应越剧烈,故A正确;
B.金属性强弱与失去电子难易程度有关,与失去电子数目多少无关,故B错误;
C.金属性越强,元素最高价氧化物对应水化物的碱性越强,故C正确;
D.金属性越强,单质与酸越容易进行,反应越剧烈,故D正确.
故答案为:Mg;ACD.
点评 本题考查元素周期表与元素周期律综合应用,侧重对元素周期律的考查,需要学生识记元素在周期表的位置,掌握金属性、非金属性强弱比较实验事实,旨在考查学生对基础知识的掌握.

 优百分课时互动系列答案
优百分课时互动系列答案 开心蛙状元作业系列答案
开心蛙状元作业系列答案 课时掌控随堂练习系列答案
课时掌控随堂练习系列答案| A. | H2和D2互为同位素 | B. | 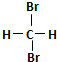 和 和 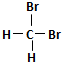 互为同分异构体 互为同分异构体 | ||
| C. | 正丁烷和异丁烷是同系物 | D. | 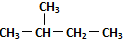 和 和 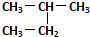 是同一种物质 是同一种物质 |
| 族 周期 | IA | IIA | IIIA | IVA | VA | VIA | VIIA |
| 1 | ① | ||||||
| 2 | ② | ③ | ④ | ||||
| 3 | ⑤ | ⑥ | ⑦ | ⑧ |
(2)在这些元素的最高价氧化物对应的水化物中,酸性最强的是HClO4,碱性最强的是NaOH,(填化学式)
(3)表中元素③的氢化物的化学式为NH3,此氢化物的稳定性比元素⑦的氢化物的稳定性强(填“强”或“弱”)
(4)①与②形成的一种化合物是沼气的主要成分,该化合物的电子式为
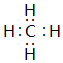
(5)⑥元素最高价氧化物对应的水化物的化学式为Al(OH)3,该物质不能(填“能”或“不能”)溶于氨水,在水中的电离方程式为AlO2-+H++H2O?Al(OH)3?Al3++3OH-.该物质与NaOH溶液反应时的离子方程式为Al(OH)3+OH-=AlO2-+H2O.
(6)⑤、⑥两元素相比较,金属性较强是Na(填元素符号),可以验证该结论的实验是AC
A、比较这两种元素最高价氧化物对应的水化物的碱性
B、比较这两种元素的气态氢化物的稳定性
C、将这两种元素的单质分别放入冷水中
D、比较这两种元素的单质与酸反应时失电子的数目.
| A. |  倾倒液体 | B. |  检查气密性 | C. | 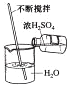 稀释浓硫酸 | D. |  取用固体 |
| A. | 在合成氨的工业生产中,使用较高温度有利于提高产量 | |
| B. | 在合成氨的工业生产中,加压有利于提高氨的产量 | |
| C. | 木炭粉碎后与O2反应,速率更快 | |
| D. | 由H2(g)、I2(g)、HI气体组成的平衡体系加压后颜色变深 |
| 化学键 | H-H | Cl-Cl | H-Cl |
| 键能 | 436kJ/mol | 243kJ/mol | 431kJ/mol |
| A. | $\frac{1}{2}$H2(g)+$\frac{1}{2}$Cl2(g)═HCl(g)△H=-91.5 kJ•mol-1 | |
| B. | H2(g)+Cl2(g)═2HCl(g)△H=-183 kJ•mol-1 | |
| C. | 2HCl(g)═H2(g)+Cl2(g)△H=183 kJ•mol-1 | |
| D. | $\frac{1}{2}$H2(g)+$\frac{1}{2}$Cl2(g)═HCl(g)△H=91.5 kJ•mol-1 |
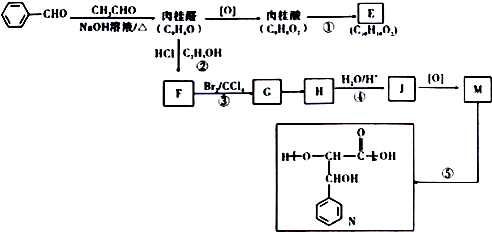
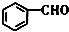 的名称是苯甲醛.
的名称是苯甲醛. ,分子中最多有18个原子共平面.
,分子中最多有18个原子共平面. .
.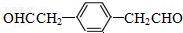 .
. 3,3,4-三甲基己烷
3,3,4-三甲基己烷  5,6-二甲基-3-乙基-1-庚炔
5,6-二甲基-3-乙基-1-庚炔 2-乙基-1,3-丁二烯
2-乙基-1,3-丁二烯  2-丁醇
2-丁醇 .
. ,若A是单烯烃与氢气加成后的产物.则该单烯烃可能有5种结构.
,若A是单烯烃与氢气加成后的产物.则该单烯烃可能有5种结构.
 .
.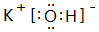 ;其中所含化学键的类型离子键、共价键.
;其中所含化学键的类型离子键、共价键.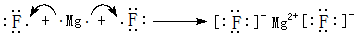 .
.