题目内容
13.下列关于HCl性质的叙述正确的是( )| A. | 氯化氢能使湿润的蓝色石蕊试纸变为红色,是因为HCl分子中含有H+ | |
| B. | 氯化氢极易溶于水,常温常压下1体积水可溶解500体积HCl | |
| C. | 氯化氢可以用向上排空气法收集 | |
| D. | 氯化氢和盐酸的化学式都是HCl |
分析 A、氯化氢是共价化合物;
B、氯化氢极易溶于水;
C、氯化氢极易溶于水,只能用排空气法收集;
D、盐酸是混合物.
解答 解:A、氯化氢是共价化合物,HCl分子中不含有H+,故A错误;
B、氯化氢极易溶于水,常温常压下1体积水可溶解约500体积HCl,故B正确;
C、氯化氢极易溶于水,只能用排空气法收集,而氯化氢的密度大于空气,所以氯化氢可以用向上排空气法收集,故C正确;
D、盐酸是混合物,无固守=定组成,所以氯化氢的化学式都是HCl,故D错误;
故选BC.
点评 本题考查氯化氢的性质和用途是最基础的考点之一,同学们只要抓住要点:性质决定用途,用途又反映性质,此类考点就迎刃而解.

练习册系列答案
 口算题卡加应用题集训系列答案
口算题卡加应用题集训系列答案
相关题目
3.含有Cu(NO3)2、Zn(NO3)2、Fe(NO3)3、AgNO3各0.1mol 的混合溶液中加入0.1mol铁粉,充分搅拌后,Fe溶解,溶液中不存在Fe3+,同时析出0.1mol Ag,下列结论错误的是( )
| A. | 溶液质量减轻 | |
| B. | Fe3+的氧化性大于Cu2+ | |
| C. | 溶液中Cu2+与Fe2+的物质的量比为1:1 | |
| D. | 1 mol Fe可还原2 mol Fe3+ |
4.部分果蔬中含有下列成分:
已知:
①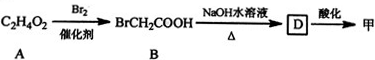
②1mol乙消耗NaHCO3 的物质的量是甲的2倍
③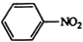 $\stackrel{Fe,HCl}{→}$
$\stackrel{Fe,HCl}{→}$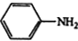 $→_{(2)H_{2}O,H+,△}^{(1)NaNO_{2},HCl}$
$→_{(2)H_{2}O,H+,△}^{(1)NaNO_{2},HCl}$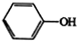
回答下列问题:
(1)甲可由已知①得到.
①甲中含有不饱和键的官能团名称为羧基.
②A→B为取代反应,A的结构简式为CH3COOH.
③B→D的化学方程式为BrCH2COOH+2NaOH$→_{△}^{H_{2}O}$HOCH2COONa+NaBr+H2O.
(2)乙在一定条件下生成链状酯类有机高分子化学物的化学方程式为n HOOCCH(OH)COOH$\stackrel{一定条件}{→}$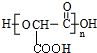 +(n-1)H2O.
+(n-1)H2O.
(3)由丙经下列途径可得一种重要的医药和香料中间体J(部分反应条件略去):
丙$→_{催化剂,△}^{H_{2}}$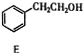 $\stackrel{经两步}{→}$
$\stackrel{经两步}{→}$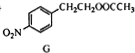 $→_{(2)H+,△}^{(1)Fe,HCl}$$\stackrel{{C}_{8}{H}_{11}NO}{H}$$→_{(2)H_{2}O,H+,△}^{(1)NaNO_{2},HCl}$J
$→_{(2)H+,△}^{(1)Fe,HCl}$$\stackrel{{C}_{8}{H}_{11}NO}{H}$$→_{(2)H_{2}O,H+,△}^{(1)NaNO_{2},HCl}$J
①用化学方法除去E中残留的少量丙(室温时E和丙呈液态,忽略它们在水中的溶解),第1步加入试剂的名称为新制氢氧化铜或银氨溶液,第2、3 步操作分别是过滤、分液.
②经E→G→H保护的官能团是羟基,可以表征有机化合物中存在何种官能团的仪器是红外光谱仪.
③J的同分异构体中在核磁共振氢谱上显示为两组峰,峰面积比为3:2的链状且不存在支链的异构体共有8种(不含立体异构),其中某异构体L中的官能团都能与H2 发生加成反应,则L的结构简式为CH3CH2COC≡CCOCH2CH3或CH3COCH2C≡CCH2COCH3(只写一种).
| 甲 | 乙 | 丙 |
| 柚子 | 黄瓜 | 脐橙 |
| HOCH2COOH | C3H4O5 | 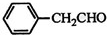 |
①
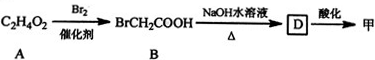
②1mol乙消耗NaHCO3 的物质的量是甲的2倍
③
 $\stackrel{Fe,HCl}{→}$
$\stackrel{Fe,HCl}{→}$ $→_{(2)H_{2}O,H+,△}^{(1)NaNO_{2},HCl}$
$→_{(2)H_{2}O,H+,△}^{(1)NaNO_{2},HCl}$
回答下列问题:
(1)甲可由已知①得到.
①甲中含有不饱和键的官能团名称为羧基.
②A→B为取代反应,A的结构简式为CH3COOH.
③B→D的化学方程式为BrCH2COOH+2NaOH$→_{△}^{H_{2}O}$HOCH2COONa+NaBr+H2O.
(2)乙在一定条件下生成链状酯类有机高分子化学物的化学方程式为n HOOCCH(OH)COOH$\stackrel{一定条件}{→}$
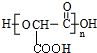 +(n-1)H2O.
+(n-1)H2O.(3)由丙经下列途径可得一种重要的医药和香料中间体J(部分反应条件略去):
丙$→_{催化剂,△}^{H_{2}}$
 $\stackrel{经两步}{→}$
$\stackrel{经两步}{→}$ $→_{(2)H+,△}^{(1)Fe,HCl}$$\stackrel{{C}_{8}{H}_{11}NO}{H}$$→_{(2)H_{2}O,H+,△}^{(1)NaNO_{2},HCl}$J
$→_{(2)H+,△}^{(1)Fe,HCl}$$\stackrel{{C}_{8}{H}_{11}NO}{H}$$→_{(2)H_{2}O,H+,△}^{(1)NaNO_{2},HCl}$J①用化学方法除去E中残留的少量丙(室温时E和丙呈液态,忽略它们在水中的溶解),第1步加入试剂的名称为新制氢氧化铜或银氨溶液,第2、3 步操作分别是过滤、分液.
②经E→G→H保护的官能团是羟基,可以表征有机化合物中存在何种官能团的仪器是红外光谱仪.
③J的同分异构体中在核磁共振氢谱上显示为两组峰,峰面积比为3:2的链状且不存在支链的异构体共有8种(不含立体异构),其中某异构体L中的官能团都能与H2 发生加成反应,则L的结构简式为CH3CH2COC≡CCOCH2CH3或CH3COCH2C≡CCH2COCH3(只写一种).
5.下表是元素周期表的一部分.
(1)②、③、④三种元素的原子半径从大到小的顺序是C>N>O(用元素符号表示)
(2)在这些元素的最高价氧化物对应的水化物中,酸性最强的是HClO4,碱性最强的是NaOH,(填化学式)
(3)表中元素③的氢化物的化学式为NH3,此氢化物的稳定性比元素⑦的氢化物的稳定性强(填“强”或“弱”)
(4)①与②形成的一种化合物是沼气的主要成分,该化合物的电子式为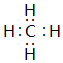
(5)⑥元素最高价氧化物对应的水化物的化学式为Al(OH)3,该物质不能(填“能”或“不能”)溶于氨水,在水中的电离方程式为AlO2-+H++H2O?Al(OH)3?Al3++3OH-.该物质与NaOH溶液反应时的离子方程式为Al(OH)3+OH-=AlO2-+H2O.
(6)⑤、⑥两元素相比较,金属性较强是Na(填元素符号),可以验证该结论的实验是AC
A、比较这两种元素最高价氧化物对应的水化物的碱性
B、比较这两种元素的气态氢化物的稳定性
C、将这两种元素的单质分别放入冷水中
D、比较这两种元素的单质与酸反应时失电子的数目.
| 族 周期 | IA | IIA | IIIA | IVA | VA | VIA | VIIA |
| 1 | ① | ||||||
| 2 | ② | ③ | ④ | ||||
| 3 | ⑤ | ⑥ | ⑦ | ⑧ |
(2)在这些元素的最高价氧化物对应的水化物中,酸性最强的是HClO4,碱性最强的是NaOH,(填化学式)
(3)表中元素③的氢化物的化学式为NH3,此氢化物的稳定性比元素⑦的氢化物的稳定性强(填“强”或“弱”)
(4)①与②形成的一种化合物是沼气的主要成分,该化合物的电子式为
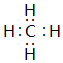
(5)⑥元素最高价氧化物对应的水化物的化学式为Al(OH)3,该物质不能(填“能”或“不能”)溶于氨水,在水中的电离方程式为AlO2-+H++H2O?Al(OH)3?Al3++3OH-.该物质与NaOH溶液反应时的离子方程式为Al(OH)3+OH-=AlO2-+H2O.
(6)⑤、⑥两元素相比较,金属性较强是Na(填元素符号),可以验证该结论的实验是AC
A、比较这两种元素最高价氧化物对应的水化物的碱性
B、比较这两种元素的气态氢化物的稳定性
C、将这两种元素的单质分别放入冷水中
D、比较这两种元素的单质与酸反应时失电子的数目.
6.以下几个热化学方程式,能表示固态碳和气态氢气燃烧时的燃烧热的热化学方程式是( )
| A. | C(s)+$\frac{1}{2}$O2(g)═CO(g)△H=+110.5 kJ•mol-1 | |
| B. | C(s)+O2(g)═CO2(g)△H=-393.5 kJ•mol-1 | |
| C. | 2H2(g)+O2(g)═2H2O(l)△H=-571.6 kJ•mol-1 | |
| D. | H2(g)+$\frac{1}{2}$O2(g)═H2O(g)△H=-241.8 kJ•mol-1 |
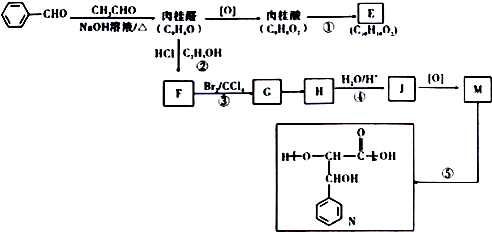
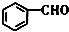 的名称是苯甲醛.
的名称是苯甲醛.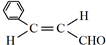 ,分子中最多有18个原子共平面.
,分子中最多有18个原子共平面. .
. .
. 此烃名称为4-甲基-1-戊炔.
此烃名称为4-甲基-1-戊炔. 的烃可命名为1-甲基-3-乙基苯.
的烃可命名为1-甲基-3-乙基苯. 的烃可命名为:2,4-二甲基-3-乙基戊烷.
的烃可命名为:2,4-二甲基-3-乙基戊烷. 的键线式:
的键线式: .
. 的键线式:
的键线式: .
.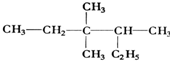 3,3,4-三甲基己烷
3,3,4-三甲基己烷 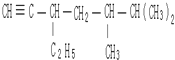 5,6-二甲基-3-乙基-1-庚炔
5,6-二甲基-3-乙基-1-庚炔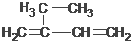 2-乙基-1,3-丁二烯
2-乙基-1,3-丁二烯 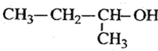 2-丁醇
2-丁醇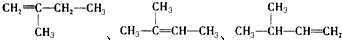 .
.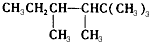 ,若A是单烯烃与氢气加成后的产物.则该单烯烃可能有5种结构.
,若A是单烯烃与氢气加成后的产物.则该单烯烃可能有5种结构.