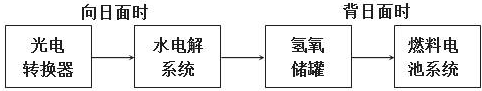
题目内容
18.为了合理利用化学能,确保安全生产,化工设计需要充分考虑化学反应的焓变,并采取相应措施.化学反应的焓变通常用实验进行测定,也可进行理论推算.(1).已知热化学方程式:
①Fe2O3(s)+3CO(g)=2Fe(s)+3CO2(g)△H=-25kJ/mol
②3Fe2O3(s)+CO(g)=2Fe3O4(s)+CO2(g)△H=-47kJ/mol
③Fe3O4(s)+CO(g)=3FeO(s)+CO2(g)△H=+19kJ/mol
写出FeO(s)被CO(g)还原成Fe(s)和CO2(g)的热化学方程式FeO(s+CO(g)=Fe(s)+CO2(g)△H=-11kJ/mol.
(2).由气态基态原子形成1mol化学键释放的最低能量叫键能.从化学键的角度分析,化学反应的过程就是反应物的化学键的破坏和生成物的化学键的形成过程.在化学反应过程中,拆开化学键需要消耗能量,形成化学键又会释放能量.
| 化学键 | H-H | N-H | N≡N |
| 键能/kJ•mol-1 | 436 | 391 | 946 |
(3).依据盖斯定律可以对某些难以通过实验直接测定的化学反应的焓变进行推算.
已知:C(s,石墨)+O2 (g)=CO2(g)△H1=-393.5kJ/mol
2H2(g)+O2 (g)=2H2O (l)△H2=-571.6kJ/mol
2C2H2(g)+5O2 (g)=4CO2 (g)+2H2O (l)△H3=-2599kJ/mol
根据盖斯定律,计算298K时反应2C(s,石墨)+H2(g)=C2H2(g)的焓变:△H=+226.7 kJ/mol.
分析 (1)首先写出FeO(s)被CO还原成Fe和CO2的热化学方程式CO(g)+FeO(s)=Fe(g)+CO2(g)△H,利用盖斯定律①×3-(③×2+②)可得到该化学方程式,以此计算△H;
(2)根据△H=反应物键能和-生成物键能和求算;
(3)已知:①C(s,石墨)+O2(g)=CO2(g)△H1=+393.5kJ/mol
②2H2(g)+O2(g)=2H2O (l)△H2=-571.6kJ/mol
③2C2H2(g)+5O2(g)=4CO2(g)+2H2O (l)△H3=-2599kJ/mol
根据盖斯定律,①×4+②-③得到反应的热化学方程式为:4C(s,石墨)+2H2(g)=2C2H2(g),据此计算.
解答 解:①Fe2O3(s)+3CO(g)=2Fe(s)+3CO2(g);△H=-25kJ/mol
②3Fe2O3(s)+CO(g)=2Fe3O4(s)+CO2(g);△H=-47kJ/mol
③Fe3O4(s)+CO(g)=3FeO(s)+CO2(g);△H=+19kJ/mol
依据盖斯定律①×3-(③×2+②)得到:
6CO(g)+6FeO(s)=6Fe(g)+6CO2(g)△H=-66kJ/mol;
得到热化学方程式为:CO(g)+FeO(s)=Fe(s)+CO2(g)△H=-11kJ/mol,
故答案为:CO(g)+FeO(s)=Fe(s)+CO2(g)△H=-11kJ/mol;
(2)△H=反应物键能和-生成物键能和=946KJ/mol+3×436KJ/mol-6×391KJ/mol=-93KJ/mol,即a=-92,
故答案为:-92;
(3)已知:①C(s,石墨)+O2(g)=CO2(g)△H1=+393.5kJ/mol
②2H2(g)+O2(g)=2H2O (l)△H2=-571.6kJ/mol
③2C2H2(g)+5O2(g)=4CO2(g)+2H2O (l)△H3=-2599kJ/mol
根据盖斯定律,①×4+②-③得到反应的热化学方程式为:4C(s,石墨)+2H2(g)=2C2H2(g) △H=+453.4kJ•mol-1;
热化学方程式为:2C(s,石墨)+H2(g)=C2H2(g) △H=+226.7kJ•mol-1,
故答案为:+226.7kJ•mol-1.
点评 本题考查了热化学方程式书写方法和盖斯定律的计算应用、利用键能计算反应热,题目难度中等,注意把握盖斯定律的含义和应用方法,侧重于考查学生的分析能力和计算能力.

 举一反三期末百分冲刺卷系列答案
举一反三期末百分冲刺卷系列答案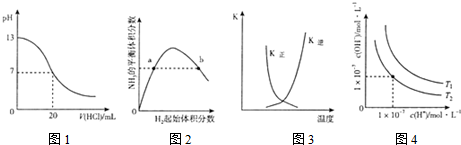
| A. | 图1表示25℃时,用0.lmol L-1盐酸滴定20mL 0.1mol•L-1NaOH溶液,溶液的pH随加入酸体积的变化 | |
| B. | 图2表示一定条件下的合成氨反应中.NH3的平衡体积分数随H2起始体积分数(N2的起始量恒定)的变化,图中a点N2的转化率大于b点 | |
| C. | 图3表示恒容密闭容器中反应“2SO2(g)+O2(g)?2SO3(g)△H<0”的平衡常数K正、K逆随温度的变化 | |
| D. | 图4表示不同温度下水溶液中H+和OH-浓度的变化的曲线,图中温度T2>T1 |
| A. | 分子数 | B. | 压强 | C. | 密度 | D. | 平均摩尔质量 |
| 实验编号 | 待测盐酸的体积(mL) | NaOH溶液的浓度(mol•L-1) | 滴定完成时,NaOH溶液滴入的体积(mL) |
| 1 | 20.00 | 0.10 | 24.18 |
| 2 | 20.00 | 0.10 | 23.06 |
| 3 | 20.00 | 0.10 | 22.96 |
(2)根据上述数据,可计算出该盐酸的浓度约为0.115mol/L(保留小数点后叁位).
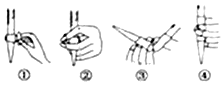
(3)排除碱式滴定管尖嘴中气泡的方法应采用丙操作,然后轻轻挤压玻璃球使尖嘴部分充满碱液.

(4)在上述实验中,下列操作(其他操作正确)会造成测定结果偏高的有C E.
A.用酸式滴定管取20.00mL待测盐酸,使用前,水洗后未用待测盐酸润洗
B.锥形瓶水洗后未干燥
C.称量NaOH固体时,有小部分NaOH潮解
D.滴定终点读数时俯视
E.碱式滴定管尖嘴部分有气泡,滴定后消失.
| A. | Cl-、Fe3+ | B. | HCO3-、Al3+ | C. | Ba2+、SO42- | D. | Na+、SO42- |