题目内容
8.下列图示与对应的叙述相符的是( )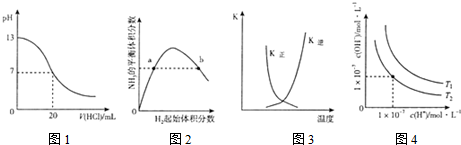
| A. | 图1表示25℃时,用0.lmol L-1盐酸滴定20mL 0.1mol•L-1NaOH溶液,溶液的pH随加入酸体积的变化 | |
| B. | 图2表示一定条件下的合成氨反应中.NH3的平衡体积分数随H2起始体积分数(N2的起始量恒定)的变化,图中a点N2的转化率大于b点 | |
| C. | 图3表示恒容密闭容器中反应“2SO2(g)+O2(g)?2SO3(g)△H<0”的平衡常数K正、K逆随温度的变化 | |
| D. | 图4表示不同温度下水溶液中H+和OH-浓度的变化的曲线,图中温度T2>T1 |
分析 A.0.1mol•L-1NaOH溶液,pH=13,用盐酸滴定时,pH减小,滴定终点时pH发生突变;
B.合成氨反应中,氢气越多,促进氮气的转化,氮气的转化率增大;
C.△H<0为放热反应,交叉点正逆反应速率相等,为平衡点,之后升高温度平衡逆向移动;
D.水的电离为吸热反应,图中T1时Kw大.
解答 解:A.0.1mol•L-1NaOH溶液,pH=13,用盐酸滴定时,pH减小,滴定终点时pH发生突变,图中没有pH的突变,故A错误;
B.合成氨反应中,氢气越多,促进氮气的转化,氮气的转化率增大,则a点N2的转化率小于b点,故B错误;
C.△H<0为放热反应,交叉点正逆反应速率相等,为平衡点,之后升高温度平衡逆向移动,K正减小、K逆增大,图象合理,故C正确;
D.水的电离为吸热反应,图中T1时Kw大,则图中温度T2<T1,故D错误;
故选C.
点评 本题考查中和滴定平衡移动的图象综合,为高频考点,把握滴定时pH的变化、平衡移动、水的电离为解答的关键,侧重分析与应用能力的考查,注意图象的分析与平衡移动原理的应用,题目难度不大.

练习册系列答案
相关题目
13.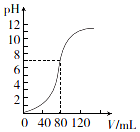 用1.0mol•L-l NaOH溶液中和某浓度H2SO4溶液时,其pH和所加NaOH溶液的体积(V)关系如图所示.则原硫酸溶液的物质的量浓度和恰好中和时溶液的总体积分别是(假设混合后溶液总体积为二者体积之和)( )
用1.0mol•L-l NaOH溶液中和某浓度H2SO4溶液时,其pH和所加NaOH溶液的体积(V)关系如图所示.则原硫酸溶液的物质的量浓度和恰好中和时溶液的总体积分别是(假设混合后溶液总体积为二者体积之和)( )
 用1.0mol•L-l NaOH溶液中和某浓度H2SO4溶液时,其pH和所加NaOH溶液的体积(V)关系如图所示.则原硫酸溶液的物质的量浓度和恰好中和时溶液的总体积分别是(假设混合后溶液总体积为二者体积之和)( )
用1.0mol•L-l NaOH溶液中和某浓度H2SO4溶液时,其pH和所加NaOH溶液的体积(V)关系如图所示.则原硫酸溶液的物质的量浓度和恰好中和时溶液的总体积分别是(假设混合后溶液总体积为二者体积之和)( )| A. | 0.5 mol•L-1、160 mL | B. | 1.0 mol•L-1、160 mL | ||
| C. | 0.5 mol•L-1、80 ml | D. | 1.0 mol•L-1、80 ml |
20.乙醇汽油是普通汽油与燃料乙醇调和而成的,乙醇的燃烧热是1366.8kJ•mol-1.燃烧1mol这种乙醇汽油生成液态水,放出的热量为Q kJ.该汽油中乙醇与汽油的物质的量之比为1:9.有关普通汽油(CxHy)燃烧的热化学方程式正确的是( )
| A. | CxHy(l)+(x+$\frac{y}{4}$)O2(g)=xCO2(g)+$\frac{y}{2}$H2O(l)△H=($\frac{10Q}{9}$-1366.8)kJ•mol-1 | |
| B. | CxHy(l)+(x+$\frac{y}{4}$)O2(g)=xCO2(g)+$\frac{y}{2}$H2O(l)△H=(-$\frac{10Q}{9}$+1366.8)kJ•mol-1 | |
| C. | CxHy(l)+(x+$\frac{y}{4}$)O2(g)=xCO2(g)+$\frac{y}{2}$H2O(l)△H=($\frac{10Q}{9}$-151.9)kJ•mol-1 | |
| D. | CxHy(l)+(x+$\frac{y}{4}$)O2(g)=xCO2(g)+$\frac{y}{2}$H2O(l)△H=(-$\frac{10Q}{9}$+151.9)kJ•mol-1 |
17. 反应mA(s)+nB(g)?pC(g)△H=-QkJ/mol在一定温度下B的体积分数(B%)与压强变化的关系如图所示,下列叙述中正确的是( )
反应mA(s)+nB(g)?pC(g)△H=-QkJ/mol在一定温度下B的体积分数(B%)与压强变化的关系如图所示,下列叙述中正确的是( )
①m+n<p;
②x点表示该反应的正反应速率大于逆反应速率;
③n>p;
④x点时比y点时的反应速率慢.
 反应mA(s)+nB(g)?pC(g)△H=-QkJ/mol在一定温度下B的体积分数(B%)与压强变化的关系如图所示,下列叙述中正确的是( )
反应mA(s)+nB(g)?pC(g)△H=-QkJ/mol在一定温度下B的体积分数(B%)与压强变化的关系如图所示,下列叙述中正确的是( )①m+n<p;
②x点表示该反应的正反应速率大于逆反应速率;
③n>p;
④x点时比y点时的反应速率慢.
| A. | 只有① | B. | 只有②④ | C. | 只有①②④ | D. | 只有①和③ |
18.为了合理利用化学能,确保安全生产,化工设计需要充分考虑化学反应的焓变,并采取相应措施.化学反应的焓变通常用实验进行测定,也可进行理论推算.
(1).已知热化学方程式:
①Fe2O3(s)+3CO(g)=2Fe(s)+3CO2(g)△H=-25kJ/mol
②3Fe2O3(s)+CO(g)=2Fe3O4(s)+CO2(g)△H=-47kJ/mol
③Fe3O4(s)+CO(g)=3FeO(s)+CO2(g)△H=+19kJ/mol
写出FeO(s)被CO(g)还原成Fe(s)和CO2(g)的热化学方程式FeO(s+CO(g)=Fe(s)+CO2(g)△H=-11kJ/mol.
(2).由气态基态原子形成1mol化学键释放的最低能量叫键能.从化学键的角度分析,化学反应的过程就是反应物的化学键的破坏和生成物的化学键的形成过程.在化学反应过程中,拆开化学键需要消耗能量,形成化学键又会释放能量.
已知反应N2(g)+3H2 (g)?2NH3(g)△H=a kJ/mol.试根据表中所列键能数据计算a为-92.
(3).依据盖斯定律可以对某些难以通过实验直接测定的化学反应的焓变进行推算.
已知:C(s,石墨)+O2 (g)=CO2(g)△H1=-393.5kJ/mol
2H2(g)+O2 (g)=2H2O (l)△H2=-571.6kJ/mol
2C2H2(g)+5O2 (g)=4CO2 (g)+2H2O (l)△H3=-2599kJ/mol
根据盖斯定律,计算298K时反应2C(s,石墨)+H2(g)=C2H2(g)的焓变:△H=+226.7 kJ/mol.
(1).已知热化学方程式:
①Fe2O3(s)+3CO(g)=2Fe(s)+3CO2(g)△H=-25kJ/mol
②3Fe2O3(s)+CO(g)=2Fe3O4(s)+CO2(g)△H=-47kJ/mol
③Fe3O4(s)+CO(g)=3FeO(s)+CO2(g)△H=+19kJ/mol
写出FeO(s)被CO(g)还原成Fe(s)和CO2(g)的热化学方程式FeO(s+CO(g)=Fe(s)+CO2(g)△H=-11kJ/mol.
(2).由气态基态原子形成1mol化学键释放的最低能量叫键能.从化学键的角度分析,化学反应的过程就是反应物的化学键的破坏和生成物的化学键的形成过程.在化学反应过程中,拆开化学键需要消耗能量,形成化学键又会释放能量.
| 化学键 | H-H | N-H | N≡N |
| 键能/kJ•mol-1 | 436 | 391 | 946 |
(3).依据盖斯定律可以对某些难以通过实验直接测定的化学反应的焓变进行推算.
已知:C(s,石墨)+O2 (g)=CO2(g)△H1=-393.5kJ/mol
2H2(g)+O2 (g)=2H2O (l)△H2=-571.6kJ/mol
2C2H2(g)+5O2 (g)=4CO2 (g)+2H2O (l)△H3=-2599kJ/mol
根据盖斯定律,计算298K时反应2C(s,石墨)+H2(g)=C2H2(g)的焓变:△H=+226.7 kJ/mol.

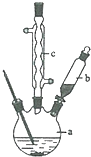 苯乙酸铜是合成优良催化剂、传感材料--纳米氧化铜的重要前驱体之一.下面是它的一种实验室合成路线:
苯乙酸铜是合成优良催化剂、传感材料--纳米氧化铜的重要前驱体之一.下面是它的一种实验室合成路线: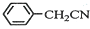 +H2O+H2SO4$\stackrel{100~130℃}{→}$
+H2O+H2SO4$\stackrel{100~130℃}{→}$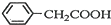 +NH4HSO4
+NH4HSO4 +Cu(OH)2→(
+Cu(OH)2→(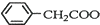 )2Cu+H2O
)2Cu+H2O