题目内容
8.某溶液中加入铝片有氢气产生,则该溶液中一定能大量共存的离子组是( )| A. | Cl-、Fe3+ | B. | HCO3-、Al3+ | C. | Ba2+、SO42- | D. | Na+、SO42- |
分析 溶液中加入铝片有氢气产生,为非氧化性酸或强碱溶液,根据离子之间不能结合生成沉淀、气体、水等,不能发生氧化还原反应等,则离子大量共存,以此来解答.
解答 解:溶液中加入铝片有氢气产生,为非氧化性酸或强碱溶液,
A.碱性溶液中不能大量存在Fe3+,故A不选;
B.碱性溶液中不能大量存在HCO3-、Al3+,且HCO3-、Al3+相互促进水解不能共存,故B不选;
C.Ba2+、SO42-结合生成沉淀,不能共存,故C不选;
D.酸、碱溶液中该组离子之间不反应,可大量共存,故D选;
故选D.
点评 本题考查离子共存,为高频考点,把握习题中的信息及常见离子之间的反应为解答的关键,侧重分析与应用能力的考查,注意复分解反应、氧化还原反应的判断,题目难度不大.

练习册系列答案
相关题目
18.为了合理利用化学能,确保安全生产,化工设计需要充分考虑化学反应的焓变,并采取相应措施.化学反应的焓变通常用实验进行测定,也可进行理论推算.
(1).已知热化学方程式:
①Fe2O3(s)+3CO(g)=2Fe(s)+3CO2(g)△H=-25kJ/mol
②3Fe2O3(s)+CO(g)=2Fe3O4(s)+CO2(g)△H=-47kJ/mol
③Fe3O4(s)+CO(g)=3FeO(s)+CO2(g)△H=+19kJ/mol
写出FeO(s)被CO(g)还原成Fe(s)和CO2(g)的热化学方程式FeO(s+CO(g)=Fe(s)+CO2(g)△H=-11kJ/mol.
(2).由气态基态原子形成1mol化学键释放的最低能量叫键能.从化学键的角度分析,化学反应的过程就是反应物的化学键的破坏和生成物的化学键的形成过程.在化学反应过程中,拆开化学键需要消耗能量,形成化学键又会释放能量.
已知反应N2(g)+3H2 (g)?2NH3(g)△H=a kJ/mol.试根据表中所列键能数据计算a为-92.
(3).依据盖斯定律可以对某些难以通过实验直接测定的化学反应的焓变进行推算.
已知:C(s,石墨)+O2 (g)=CO2(g)△H1=-393.5kJ/mol
2H2(g)+O2 (g)=2H2O (l)△H2=-571.6kJ/mol
2C2H2(g)+5O2 (g)=4CO2 (g)+2H2O (l)△H3=-2599kJ/mol
根据盖斯定律,计算298K时反应2C(s,石墨)+H2(g)=C2H2(g)的焓变:△H=+226.7 kJ/mol.
(1).已知热化学方程式:
①Fe2O3(s)+3CO(g)=2Fe(s)+3CO2(g)△H=-25kJ/mol
②3Fe2O3(s)+CO(g)=2Fe3O4(s)+CO2(g)△H=-47kJ/mol
③Fe3O4(s)+CO(g)=3FeO(s)+CO2(g)△H=+19kJ/mol
写出FeO(s)被CO(g)还原成Fe(s)和CO2(g)的热化学方程式FeO(s+CO(g)=Fe(s)+CO2(g)△H=-11kJ/mol.
(2).由气态基态原子形成1mol化学键释放的最低能量叫键能.从化学键的角度分析,化学反应的过程就是反应物的化学键的破坏和生成物的化学键的形成过程.在化学反应过程中,拆开化学键需要消耗能量,形成化学键又会释放能量.
| 化学键 | H-H | N-H | N≡N |
| 键能/kJ•mol-1 | 436 | 391 | 946 |
(3).依据盖斯定律可以对某些难以通过实验直接测定的化学反应的焓变进行推算.
已知:C(s,石墨)+O2 (g)=CO2(g)△H1=-393.5kJ/mol
2H2(g)+O2 (g)=2H2O (l)△H2=-571.6kJ/mol
2C2H2(g)+5O2 (g)=4CO2 (g)+2H2O (l)△H3=-2599kJ/mol
根据盖斯定律,计算298K时反应2C(s,石墨)+H2(g)=C2H2(g)的焓变:△H=+226.7 kJ/mol.
19.下列反应中,电子转移发生在同种元素之间的是( )
| A. | 2KClO3$\frac{\underline{\;\;△\;\;}}{\;}$2KCl+3O2↑ | B. | 2KMnO4$\frac{\underline{\;\;△\;\;}}{\;}$K2MnO4+MnO2+O2↑ | ||
| C. | H2S+Cl2=S+2HCl | D. | Cu2O+H2SO4=CuSO4+Cu+H2O |
16.下列反应中不属于氧化还原反应的是( )
| A. | 3CuS+8HNO3=3Cu(NO3)2+2NO↑+3S↓+4H2O | |
| B. | 3Cl2+6KOH=5KCl+KClO3+3H2O | |
| C. | 3CCl4+K2Cr2O7=2CrO2C12+3COCl2+2KCl | |
| D. | 2KMnO4$\frac{\underline{\;\;△\;\;}}{\;}$ K2MnO4+MnO2+O2↑ |
3.下列关于氯气的实验装置能达到实验目的或实验效果的是( )
| A. | 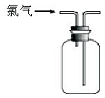 可用于氯气的收集 | B. | 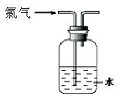 用于除去氯气中少量的氯化氢气体 | ||
| C. |  可证明氯气具有漂白性 | D. | 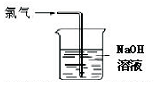 可用于实验室氯气的尾气吸收 |
13.下列实验中能得到Fe2O3 的是( )
| A. | 铁丝在纯氧中燃烧 | B. | 红热的铁和水蒸气反应 | ||
| C. | 将Fe2(SO4)3 溶液蒸干后灼烧 | D. | 加热氢氧化铁固体 |
20.氯碱工业是以电解饱和食盐水为基础的工业.饱和食盐水是以含Ca2+、Mg2+、SO42-、Fe3+等杂质离子的粗盐水精制,需要使用的药品包括:①稀盐酸 ②烧碱溶液 ③碳酸钠溶液 ④氯化钡溶液.下列有关说法不正确的是( )
| A. | 加入烧碱溶液主要是除去Mg2+、Fe3+ | |
| B. | 药品加入的先后顺序可以是②③④① | |
| C. | 加入稀盐酸主要是除去所加过量物质中的OH-、CO32- | |
| D. | 加入碳酸钠溶液主要是除去Ca2+及所加过量物质中的Ba2+ |
17.有一瓶Na2SO3溶液,由于它可能部分被氧化,某同学进行如下实验:取少量溶液,滴入Ba(NO3)2溶液,产生白色沉淀,再加入足量稀硝酸,充分振荡后,仍有白色沉淀.对此实验下述结论正确的是( )
| A. | 加硝酸后的不溶性沉淀一定是BaSO4 | |
| B. | Na2SO3已部分被空气中的氧气氧化 | |
| C. | 加入Ba(NO3)2溶液后,生成的沉淀中一定含有BaSO4 | |
| D. | 此实验能确定Na2SO3是否被部分氧化 |
3.硫酸锶(SrSO4)在水中的沉淀溶解平衡曲线如右图所示.下列说法正确的是( )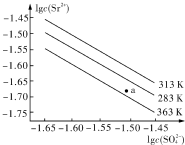

| A. | 温度一定时,KSP(SrSO4)随c(SO42-)的增大而减小 | |
| B. | 三个不同温度中,313K时KSP(SrSO4)最大 | |
| C. | 283K时,图中a点对应的溶液是饱和溶液 | |
| D. | 283K下的SrSO4饱和溶液升温到363K后变为不饱和溶液 |