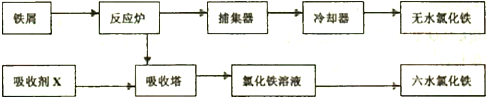
题目内容
6.实验室中有一未知浓度的稀盐酸,某学生用0.10mol•L-1 NaOH标准溶液进行测定盐酸的浓度的实验.取20.00mL待测盐酸放入锥形瓶中,并滴加2~3滴酚酞作指示剂,用自己配制的NaOH标准溶液进行滴定.重复上述滴定操作2~3次,记录数据如下.请完成下列填空:| 实验编号 | 待测盐酸的体积(mL) | NaOH溶液的浓度(mol•L-1) | 滴定完成时,NaOH溶液滴入的体积(mL) |
| 1 | 20.00 | 0.10 | 24.18 |
| 2 | 20.00 | 0.10 | 23.06 |
| 3 | 20.00 | 0.10 | 22.96 |
(2)根据上述数据,可计算出该盐酸的浓度约为0.115mol/L(保留小数点后叁位).
(3)排除碱式滴定管尖嘴中气泡的方法应采用丙操作,然后轻轻挤压玻璃球使尖嘴部分充满碱液.

(4)在上述实验中,下列操作(其他操作正确)会造成测定结果偏高的有C E.
A.用酸式滴定管取20.00mL待测盐酸,使用前,水洗后未用待测盐酸润洗
B.锥形瓶水洗后未干燥
C.称量NaOH固体时,有小部分NaOH潮解
D.滴定终点读数时俯视
E.碱式滴定管尖嘴部分有气泡,滴定后消失.
分析 (1)如溶液颜色发生突变且半分钟内不恢复颜色,可说明达到滴定终点;
(2)根据滴定消耗的标准液的体积判断数据的有效性,然后计算出标准液的平均体积,然后依据c(待测)=$\frac{c(标准)×V(标准)}{V(待测)}$计算解答;
(3)碱式滴定管的气泡通常橡皮管内,只要将滴定玻璃头朝上,并挤橡皮管中的玻璃珠就可以将气泡冲排出;
(4)根据c(待测)=$\frac{c(标准)×V(标准)}{V(待测)}$分析不当操作对V(标准)的影响,以此判断浓度的误差.
解答 解:(1)酚酞在酸中为无色,在碱性溶液中显浅红色,滴定时,当最后一滴NaOH溶液加入,溶液由无色恰好变成浅红色且半分钟内不褪色,可说明达到滴定终点;
故答案为:最后一滴NaOH溶液加入,溶液由无色恰好变成浅红色且半分钟内不褪色;
(2)依据图中数据可知第一组数据误差较大,舍去误差较大的数,得出V(标准)=$\frac{23.06+22.96}{2}$=23.01mL,c(待测)=$\frac{c(标准)×V(标准)}{V(待测)}$=$\frac{0.10mol/L×23.01mL}{20.00mL}$=0.115mol/L,
故答案为:0.115mol/L;
(3)碱式滴定管的气泡通常橡皮管内,只要将滴定玻璃头朝上,并挤橡皮管中的玻璃珠就可以将气泡冲排出;
故答案为:丙;
(4)A.酸式滴定管使用前,水洗后未用待测盐酸润洗,待测液的物质的量偏小,造成V(标准)偏小,根据c(待测)公式分析,可知c(标准)偏小,故A错误;
B.锥形瓶洗涤后不干燥,对结果无影响,故B错误;
C.称量NaOH固体时,有小部分NaOH潮解,以酚酞为指示剂时等质量的氢氧化钠和潮解的氢氧化钠消耗的氢氧化钠后者大,所以造成V(标准)偏大,故C正确;
D.滴定终点读数时俯视读,造成V(标准)偏小,根据c(待测)公式分析,可知c(标准)偏小,故D错误;
E.碱式滴定管尖嘴部分有气泡,滴定后消失,造成V(标准)偏大,根据c(待测)公式分析,可知c(标准)偏大,故E正确;
故选:CE.
点评 本题考查中和滴定操作,明确中和滴定实验的原理及操作是解题关键,注意把握实验基本方法,能会分析导致误差的不当操作,注意把握实验操作要点和注意事项,题目难度中等.

 反应mA(s)+nB(g)?pC(g)△H=-QkJ/mol在一定温度下B的体积分数(B%)与压强变化的关系如图所示,下列叙述中正确的是( )
反应mA(s)+nB(g)?pC(g)△H=-QkJ/mol在一定温度下B的体积分数(B%)与压强变化的关系如图所示,下列叙述中正确的是( )①m+n<p;
②x点表示该反应的正反应速率大于逆反应速率;
③n>p;
④x点时比y点时的反应速率慢.
| A. | 只有① | B. | 只有②④ | C. | 只有①②④ | D. | 只有①和③ |
(1)实验测得,标准状况下11.2L甲烷在氧气中充分燃烧生成液态水和二氧化碳气体时释放出a kJ的热量,试写出表示甲烷燃烧热的热化学方程式:2CH3OH(g)+3O2(g)═2CO2(g)+4H2O(l)△H=-1452.8KJ/mol;
(2)已知反应CH3-CH3(g)→CH2═CH2(g)+H2(g),有关化学键的键能如下:
| 化学键 | C-H | C═C | C-C | H-H |
| 键能/kJ•mol-1 | 414.4 | 615.3 | 347.3 | 435.3 |
(3)依据盖斯定律可以对某些难以通过实验直接测定的化学反应的焓变进行推算.
已知:C(s,石墨)+O2(g)═CO2(g)△H1=-393.5kJ•mol-1
2H2(g)+O2(g)═2H2O(l)△H2=-571.6kJ•mol-1
2C2H2(g)+5O2(g)═4CO2(g)+2H2O(l)△H3=-2 599kJ•mol-1
根据盖斯定律,计算25OC时由C(s,石墨)和H2(g)生成1mol C2H2(g)反应的焓变:△H= +227.7kJ•mol-1.
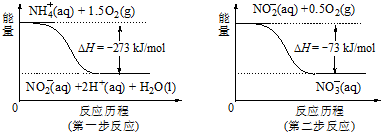
①第一步反应是放热反应(选题“放热”或“吸热”),判断依据是反应物的总能量大于生成物的总能量
②1mol NH4+(aq)全部氧化成NO3- (aq)的热化学方程式是NH4+(aq)+2O2(g)═2H+(aq)+H2O(l)+NO3-(aq),△H=-346 kJ/mol
(2)用酸式滴定管准确移取25.00mL某未知浓度的盐酸于一洁净的锥形瓶中,然后用0.20mol•L-1的氢氧化钠溶液(指示剂为酚酞)滴定,滴定结果如下:
| 实验编号 | NaOH起始读数 | NaOH终点读数 |
| 第一次 | 0.10mL | 18.40mL |
| 第二次 | 3.00mL | 21.10mL |
| 第三次 | 0.20mL | 20.40mL |
| 第四次 | 0.00mL | 18.20mL |
②判断滴定终点的现象是无色变粉红色,且半分钟内不变色
③根据以上数据可以计算出盐酸的物质的量浓度为0.15 mol•L-1(小数点后保留两位有效数字).
④以下操作可能造成测定结果偏高的是ACE(填写序号).
A.滴定前,碱式滴定管尖嘴有气泡,滴定后消失
B.滴定前读数正确,达到滴定终点后,俯视读数
C.滴定到终点读数时发现滴定管尖嘴处悬挂一滴溶液
D.盛装未知液的锥形瓶用蒸馏水洗后,未用待测液润洗
E.未用标准液润洗碱式滴定管
(3)由pH=3的HA(弱酸)与pH=11的NaOH溶液等体积混合,所得溶液中离子浓度大小的顺序为c(A-)>c(Na+)>c(H+)>c(OH-).
(1).已知热化学方程式:
①Fe2O3(s)+3CO(g)=2Fe(s)+3CO2(g)△H=-25kJ/mol
②3Fe2O3(s)+CO(g)=2Fe3O4(s)+CO2(g)△H=-47kJ/mol
③Fe3O4(s)+CO(g)=3FeO(s)+CO2(g)△H=+19kJ/mol
写出FeO(s)被CO(g)还原成Fe(s)和CO2(g)的热化学方程式FeO(s+CO(g)=Fe(s)+CO2(g)△H=-11kJ/mol.
(2).由气态基态原子形成1mol化学键释放的最低能量叫键能.从化学键的角度分析,化学反应的过程就是反应物的化学键的破坏和生成物的化学键的形成过程.在化学反应过程中,拆开化学键需要消耗能量,形成化学键又会释放能量.
| 化学键 | H-H | N-H | N≡N |
| 键能/kJ•mol-1 | 436 | 391 | 946 |
(3).依据盖斯定律可以对某些难以通过实验直接测定的化学反应的焓变进行推算.
已知:C(s,石墨)+O2 (g)=CO2(g)△H1=-393.5kJ/mol
2H2(g)+O2 (g)=2H2O (l)△H2=-571.6kJ/mol
2C2H2(g)+5O2 (g)=4CO2 (g)+2H2O (l)△H3=-2599kJ/mol
根据盖斯定律,计算298K时反应2C(s,石墨)+H2(g)=C2H2(g)的焓变:△H=+226.7 kJ/mol.
| A. | 3CuS+8HNO3=3Cu(NO3)2+2NO↑+3S↓+4H2O | |
| B. | 3Cl2+6KOH=5KCl+KClO3+3H2O | |
| C. | 3CCl4+K2Cr2O7=2CrO2C12+3COCl2+2KCl | |
| D. | 2KMnO4$\frac{\underline{\;\;△\;\;}}{\;}$ K2MnO4+MnO2+O2↑ |