题目内容
10.滴定法是分析化学中常用实验方法,请根据滴定法的有关知识回答下列问题:I、某学生用0.1mol•L-1 的KOH标准溶液滴定未知浓度的盐酸,其操作分解为如下几步:
A.移取20mL待测盐酸溶液注入洁净的锥形瓶中,并加入2~3滴酚酞;
B.用标准溶液润洗滴定管2~3次;
C.把盛有标准溶液的碱式滴定管固定好,调节滴定管尖嘴使之充满溶液;
D.取标准KOH溶液注入碱式滴定管至刻度“0”以上1~2cm 处;
E.调节液面至“0”或“0”以下刻度,记下读数;
F.把锥形瓶放在滴定管的下面,用标准KOH溶液滴定至终点并记下滴定管液面的刻度.
就此实验完成填空:
(1)正确操作步骤的顺序是(用序号字母填写)BDCEAF.
(2)上述B步骤操作的目的是防止标准溶液被稀释,引起误差.
(3)在进行C步操作滴定前排气泡时,应选择图2中的③(填序号),若用25mL滴定管进行实验,当滴定管中的液面在“10”处,则管内液体的体积(填序号)④(①=10mL,②=15mL,③<10mL,④>15mL).

(4)判断以下操作,对测定结果盐酸浓度的影响(填“偏高”、“偏低”或““无影响”)
①上述A步骤操作之前,若先用待测溶液润洗锥形瓶,则对滴定结果的影响是偏高.
②若称取一定量的KOH固体(含少量NaOH)配制标准溶液并用来滴定上述盐酸,则对滴定结果产生的影响是偏低.
③如果滴定前装有待测溶液的酸式滴定管尖嘴部分有气泡,而滴定结束后气泡消失,则测定结果将偏低.
分析 (1)中和滴定有检漏、洗涤、润洗、装液、取待测液于锥形瓶,然后加入指示剂进行滴定等操作;
(2)直接装入标准溶液,标准液的浓度偏低;
(3)氢氧化钠溶液为碱性溶液,应该使用碱式滴定管,碱式滴定管中排气泡的方法:把滴定管的胶头部分稍微向上弯曲,再排气泡,所以排除碱式滴定管中的空气用③的方法;若用25mL滴定管进行实验,当滴定管中的液面在刻度“10”处,滴定管的0刻度在上方,10mL刻度线下方还有15mL有刻度的溶液,另外滴定管25L刻度线下有液体没有刻度;.
(4)①如用待测液润洗锥形瓶,则导致待测液所含的溶质的物质的量偏多;
②KOH中含有NaOH,等质量时含有的碱的浓度偏大;
③有气泡式导致溶液体积偏大.
解答 解:(1)操作的步骤是选择滴定管,然后洗涤、装液、使尖嘴充满溶液、固定在滴定台上,然后调节液面记下读数.再取待测液于锥形瓶,然后加入指示剂进行滴定,所以顺序为:B、D、C、E、A、F,
故答案为:BDCE;
(2)滴定管用蒸馏水洗涤后,内壁有一层水膜,如果直接装液会使浓度降低,所以必须用标准溶液润洗滴定管2-3次,
故答案为:防止标准溶液被稀释,引起误差;
(3)氢氧化钠溶液为碱性溶液,应该使用碱式滴定管,碱式滴定管中排气泡的方法:把滴定管的胶头部分稍微向上弯曲,再排气泡,所以排除碱式滴定管中的空气用③的方法;若用25mL滴定管进行实验,当滴定管中的液面在刻度“10”处,滴定管的0刻度在上方,10mL刻度线下方还有15mL有刻度的溶液,另外滴定管25L刻度线下有液体没有刻度,则滴定管内液体大于15mL,故答案为:③;④;
(4)①如用待测液润洗锥形瓶,则导致待测液所含的溶质的物质的量偏多,则消耗的KOH偏多,测定结果偏高,故答案为:偏高;
②KOH中含有NaOH,等质量时含有的碱的浓度偏大,需要体积偏小,则测定结果偏低,故答案为:偏低;
③有气泡式导致溶液体积偏大,而消耗氢氧化钾的物质的量不变,则实际测定浓度偏低,故答案为:偏低.
点评 本题考查测量物质的含量的方法,为高频考点,要求学生掌握探究物质组成、测量物质含量的方法,把握中和滴定的操作方法及计算方法,试题培养了学生的分析能力及化学实验能力.

| A. | CxHy(l)+(x+$\frac{y}{4}$)O2(g)=xCO2(g)+$\frac{y}{2}$H2O(l)△H=($\frac{10Q}{9}$-1366.8)kJ•mol-1 | |
| B. | CxHy(l)+(x+$\frac{y}{4}$)O2(g)=xCO2(g)+$\frac{y}{2}$H2O(l)△H=(-$\frac{10Q}{9}$+1366.8)kJ•mol-1 | |
| C. | CxHy(l)+(x+$\frac{y}{4}$)O2(g)=xCO2(g)+$\frac{y}{2}$H2O(l)△H=($\frac{10Q}{9}$-151.9)kJ•mol-1 | |
| D. | CxHy(l)+(x+$\frac{y}{4}$)O2(g)=xCO2(g)+$\frac{y}{2}$H2O(l)△H=(-$\frac{10Q}{9}$+151.9)kJ•mol-1 |
(1)实验测得,标准状况下11.2L甲烷在氧气中充分燃烧生成液态水和二氧化碳气体时释放出a kJ的热量,试写出表示甲烷燃烧热的热化学方程式:2CH3OH(g)+3O2(g)═2CO2(g)+4H2O(l)△H=-1452.8KJ/mol;
(2)已知反应CH3-CH3(g)→CH2═CH2(g)+H2(g),有关化学键的键能如下:
| 化学键 | C-H | C═C | C-C | H-H |
| 键能/kJ•mol-1 | 414.4 | 615.3 | 347.3 | 435.3 |
(3)依据盖斯定律可以对某些难以通过实验直接测定的化学反应的焓变进行推算.
已知:C(s,石墨)+O2(g)═CO2(g)△H1=-393.5kJ•mol-1
2H2(g)+O2(g)═2H2O(l)△H2=-571.6kJ•mol-1
2C2H2(g)+5O2(g)═4CO2(g)+2H2O(l)△H3=-2 599kJ•mol-1
根据盖斯定律,计算25OC时由C(s,石墨)和H2(g)生成1mol C2H2(g)反应的焓变:△H= +227.7kJ•mol-1.
(1).已知热化学方程式:
①Fe2O3(s)+3CO(g)=2Fe(s)+3CO2(g)△H=-25kJ/mol
②3Fe2O3(s)+CO(g)=2Fe3O4(s)+CO2(g)△H=-47kJ/mol
③Fe3O4(s)+CO(g)=3FeO(s)+CO2(g)△H=+19kJ/mol
写出FeO(s)被CO(g)还原成Fe(s)和CO2(g)的热化学方程式FeO(s+CO(g)=Fe(s)+CO2(g)△H=-11kJ/mol.
(2).由气态基态原子形成1mol化学键释放的最低能量叫键能.从化学键的角度分析,化学反应的过程就是反应物的化学键的破坏和生成物的化学键的形成过程.在化学反应过程中,拆开化学键需要消耗能量,形成化学键又会释放能量.
| 化学键 | H-H | N-H | N≡N |
| 键能/kJ•mol-1 | 436 | 391 | 946 |
(3).依据盖斯定律可以对某些难以通过实验直接测定的化学反应的焓变进行推算.
已知:C(s,石墨)+O2 (g)=CO2(g)△H1=-393.5kJ/mol
2H2(g)+O2 (g)=2H2O (l)△H2=-571.6kJ/mol
2C2H2(g)+5O2 (g)=4CO2 (g)+2H2O (l)△H3=-2599kJ/mol
根据盖斯定律,计算298K时反应2C(s,石墨)+H2(g)=C2H2(g)的焓变:△H=+226.7 kJ/mol.
| A. | C8H18(l)+$\frac{25}{2}$O2(g)═8CO2(g)+9H2O(g)△H=-48.4 kJ•mol-1 | |
| B. | C8H18(l)+$\frac{25}{2}$O2(g)═8CO2(g)+9H2O(l)△H=-5517.6 kJ•mol-1 | |
| C. | C8H18(l)+$\frac{25}{2}$O2(g)═8CO2(g)+9H2O(l)△H=+5517.6 kJ•mol-1 | |
| D. | C8H18(l)+$\frac{25}{2}$O2(g)═8CO2(g)+9H2O(l)△H=-48.4 kJ•mol-1 |
(1)已知:①CH4(g)+H2O(g)?CO(g)+3H2(g)△H1=+206.1kJ•mol-1
②2H2(g)+CO(g)?CH3OH(l)△H2=-128.3kJ•mol-1
③2H2(g)+O2(g)?2H2O (g)△H3=-483.6kJ•mol-1
25℃时,在合适的催化剂作用下,采用甲烷和氧气一步合成液态甲醇的热化学方程式为CH4(g)+$\frac{1}{2}$O2(g)?CH3OH(l)△H1=-164.0kJ•mol-1.
(2)利用反应①来制备氢气,为了探究温度、压强对反应①速率、转化率的影响,某同学设计了以下三组对比实验(温度为400℃或500℃,压强为101kPa或404kPa).
| 实验序号 | 温度℃ | 压强/kPa | CH4初始浓度/mol•L-1 | H2O初始浓度/mol•L-1 |
| 1 | 400 | p | 3.0 | 7.0 |
| 2 | t | 101 | 3.0 | 7.0 |
| 3 | 400 | 101 | 3.0 | 7.0 |
②将等物质的量的CH4和水蒸气充入1L恒容密闭容器中,发生上述反应,在400℃下达到平衡,平衡常数K=27,此时容器中CO物质的量为0.10mol,则CH4的转化率为90.9%.
(3)科学家提出由CO2制 取 C的太阳能工艺如图1所示.
2“重整系统”发生的反应中n(FeO):n(CO2)=6:1,则Fe xOy的化学式为Fe3O4.
②“热分解系统”中每分解l mol Fe xOy,转移电子的物质的量为2mol.
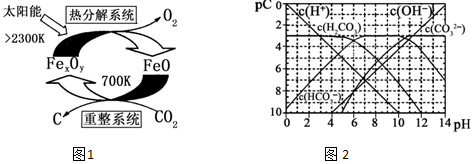
(4)pC类似pH,是指极稀溶液中的溶质浓度的常用负对数值.若某溶液中溶质的浓度为1×10-3mol•L-1,则该溶液中溶质的pC=-lg(1×10-3)=3.如图2为25℃时H2CO3溶液的pC-pH图.请回答下列问题 (若离子浓度小于10-5mol/L,可认为该离子不存在):
①在同一溶液中,H2CO3、HCO3-、CO32-不能(填“能”或“不能”)大量共存.
②求H2CO3一级电离平衡常数的数值Ka1=1×10-6.
③人体血液里主要通过碳酸氢盐缓冲体系$\frac{c({H}_{2}C{O}_{3})}{c(HC{O}_{3}^{-})}$可以抵消少量酸或碱,维持pH=7.4.当过量的酸进入血液中时,血液缓冲体系中的$\frac{c({H}^{+})}{c({H}_{2}C{O}_{3})}$最终将A.
A.变大B.变小C.基本不变D.无法判断.
| A. | 2KClO3$\frac{\underline{\;\;△\;\;}}{\;}$2KCl+3O2↑ | B. | 2KMnO4$\frac{\underline{\;\;△\;\;}}{\;}$K2MnO4+MnO2+O2↑ | ||
| C. | H2S+Cl2=S+2HCl | D. | Cu2O+H2SO4=CuSO4+Cu+H2O |
| A. | 加入烧碱溶液主要是除去Mg2+、Fe3+ | |
| B. | 药品加入的先后顺序可以是②③④① | |
| C. | 加入稀盐酸主要是除去所加过量物质中的OH-、CO32- | |
| D. | 加入碳酸钠溶液主要是除去Ca2+及所加过量物质中的Ba2+ |
