题目内容
1.现有A、B、C、D、E、F、G、H、M九种物质,其中A为淡黄色粉末,G为黄绿色气体单质,E为无色气体单质,F的水溶液与石灰水混合可得D的溶液,它们之间的相互转化关系如图所示,其他与题无关的生成物均已略去.
请回答下列问题:
(1)写出E、H的化学式:EO2,HNaClO.
(2)写出①、⑤的化学方程式:
①2Na2O2+2H2O=4NaOH+O2↑,⑤2HClO$\frac{\underline{\;光照\;}}{\;}$HCl+O2↑.
(3)写出③的离子方程式:2ClO-+H2O+CO2=2HClO+CO32-.
分析 现有A、B、C、D、E、F、G、H、M九种物质,A为淡黄色粉末,则A为Na2O2,A能与C反应得到E与F,且C为气体,E为气体单质,可推知C为CO2,E为O2,F为Na2CO3,F的水溶液与澄清石灰水混合可制得D的溶液,则D为NaOH,而A与B反应得到D,故B为H2O,G为黄绿色气体单质,为Cl2,与氢氧化钠溶液反应得到H,H与二氧化碳、水反应得到M,M光照可以生成氧气,可推知M为HClO,H为NaClO,以此解答该题.
解答 解:(1)由上述分析可知,E为O2,H为NaClO,故答案为:O2;NaClO;
(2)①为过氧化钠和水的反应,方程式为2Na2O2+2H2O=4NaOH+O2↑,⑤为次氯酸的分解,方程式为2HClO$\frac{\underline{\;光照\;}}{\;}$HCl+O2↑,
故答案为:2Na2O2+2H2O=4NaOH+O2↑;2HClO$\frac{\underline{\;光照\;}}{\;}$HCl+O2↑;
(3)③为NaClO与二氧化碳的反应,生成HClO,离子方程式为2ClO-+H2O+CO2=2HClO+CO32-,故答案为:2ClO-+H2O+CO2=2HClO+CO32-.
点评 本题考查无机物推断,为高考常见题型,涉及Na、Cl元素单质化合物性质,“淡黄色粉末A与气体C反应得到气体单质E”是推断突破口,需要学生熟练注意元素化合物知识,难度不大.

练习册系列答案
相关题目
11.下列叙述正确的是( )
| A. | 1mol任何气体的体积都是22.4L | |
| B. | 在非标准状况下,1mol任何气体的体积不可能是22.4L | |
| C. | 在标准状况下,NA个混合气体分子的体积约为22.4L | |
| D. | 同温同压下两种气体,只要它们的分子数相同,所占体积也一定相同 |
12.下列物质是电解质的是( )
| A. | 铜 | B. | 酒精 | C. | 硫酸溶液 | D. | 硫酸钡 |
9.下列反应中,不属于氧化还原反应的是( )
| A. | 2H2O2═2H2O+O2↑ | B. | 2FeCl2+Cl2═2FeCl3 | ||
| C. | Pb2++2Cl-═PbCl2↓ | D. | Sn2++2Fe3+═Sn4++2Fe2+ |
16.某同学通过系列实验探究Mg及其化合物的性质,操作正确且能达到目的是( )
| A. | 将水加入浓硫酸中得到稀硫酸,置镁条于其中探究Mg的活泼性 | |
| B. | 将NaOH溶液缓慢滴入MgSO4溶液中,观察Mg(OH)2沉淀的生成 | |
| C. | 将Mg(OH)2浊液直接倒入已装好滤纸的漏斗中过滤,洗涤并收集沉淀 | |
| D. | 将镁蒸气在氮气中冷却得到镁粉 |
6.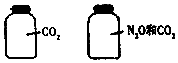 如图所示.两瓶体积相等的气体,在同温同压时瓶内气体(N2O和CO2不反应)关系一定不正确的是( )
如图所示.两瓶体积相等的气体,在同温同压时瓶内气体(N2O和CO2不反应)关系一定不正确的是( )
 如图所示.两瓶体积相等的气体,在同温同压时瓶内气体(N2O和CO2不反应)关系一定不正确的是( )
如图所示.两瓶体积相等的气体,在同温同压时瓶内气体(N2O和CO2不反应)关系一定不正确的是( )| A. | 所含氧原子数相等 | B. | 气体的总质量相等 | ||
| C. | 气体的平均摩尔质量相等 | D. | 气体的密度相等 |
13.胶体区别于其他分散系的本质特征是( )
| A. | 加热会聚沉 | B. | 分散质颗粒大小在1-100nm之间 | ||
| C. | 胶体微粒不能透过半透膜 | D. | 产生丁达尔现象 |
10.设NA表示阿伏加德罗常数,下列说法中不正确的是( )
| A. | 25℃时,纯水中含有的H+数为1×10-7NA | |
| B. | 常温常压下,31g白磷与红磷的混合物中含有磷原子数为NA | |
| C. | 35.5gCl2参加氧化还原反应,转移的电子数可能为NA | |
| D. | 7.8gNa2O2晶体中所含离子的总数为0.3NA |
18.下列反应的离子方程式书写正确的是( )
| A. | 锌溶于醋酸:Zn+2H+=Zn2++H2↑ | |
| B. | 氯气与溴化钠溶液:2Br-+Cl2=Br2+2Cl- | |
| C. | 氯化铝与氨水:Al3++3OH-=Al(OH)3↓ | |
| D. | 氯气溶于水:Cl2+H2O?2H++Cl-+ClO- |