题目内容
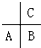 短周期元素A、B、C(均不为稀有气体元素)在周期表中的位置如图:下列说法正确的是( )
短周期元素A、B、C(均不为稀有气体元素)在周期表中的位置如图:下列说法正确的是( )| A、若均为非金属元素,其气态氢化物稳定性:A<B<C |
| B、若均为金属元素,其最高价氧化物的水化物的碱性:A<B<C |
| C、原子半径:A>C>B |
| D、最高正价:A>B>C |
考点:位置结构性质的相互关系应用
专题:元素周期律与元素周期表专题
分析:三种元素不是稀有气体,都属于短周期元素,根据元素周期表结构可知,C一定位于第2周期,A、B位于第3周期,
A.非金属性越强,对应的气态氢化物越稳定;
B.金属性越强,最高价氧化物对应的水化物碱性越强;
C.电子层越多,半径越大,电子层相同时,核电荷数越大,半径越小;
D.短周期元素中,同一周期,最高正价从左向右逐渐增大;同一主族,如果有最高正价,则其最高正价相等.
A.非金属性越强,对应的气态氢化物越稳定;
B.金属性越强,最高价氧化物对应的水化物碱性越强;
C.电子层越多,半径越大,电子层相同时,核电荷数越大,半径越小;
D.短周期元素中,同一周期,最高正价从左向右逐渐增大;同一主族,如果有最高正价,则其最高正价相等.
解答:
解:三种元素不是稀有气体,且都属于短周期元素,根据元素周期表结构可知,C一定位于第2周期,A、B位于第3周期,
A.若均为非金属元素,非金属性大小为:C>B>A,非金属性越强,对应的气态氢化物越稳定,则对应的气态氢化物稳定性大小为:C>B>A,故A正确;
B.若均为金属元素,则金属性强弱为:A>B>C,金属性越强,最高价氧化物对应的水化物碱性越强,则其最高价氧化物的水化物的碱性为:C<B<A,故B错误;
C.电子层越多,半径越大,当具有相同电子层时,原子的原子序数越大其原子半径越小,则A、B、C的原子半径大小为:A>B>C,故C错误;
D.C若为F,则没有最高正价,若C不是F,B、C元素的总共正价相同,二者的最高正价都大于A,故D错误;
故选A.
A.若均为非金属元素,非金属性大小为:C>B>A,非金属性越强,对应的气态氢化物越稳定,则对应的气态氢化物稳定性大小为:C>B>A,故A正确;
B.若均为金属元素,则金属性强弱为:A>B>C,金属性越强,最高价氧化物对应的水化物碱性越强,则其最高价氧化物的水化物的碱性为:C<B<A,故B错误;
C.电子层越多,半径越大,当具有相同电子层时,原子的原子序数越大其原子半径越小,则A、B、C的原子半径大小为:A>B>C,故C错误;
D.C若为F,则没有最高正价,若C不是F,B、C元素的总共正价相同,二者的最高正价都大于A,故D错误;
故选A.
点评:本题考查了物质、结构与性质的应用,题目难度中等,根据题干信息及所学知识正确推断各元素名称为解答关键,注意掌握原子结构与元素周期表、元素周期律的关系,试题有利于培养学生的分析、理解能力及灵活应用所学知识解决实际问题能力.

练习册系列答案
 智能训练练测考系列答案
智能训练练测考系列答案
相关题目
同温同压下,1体积X2气体与3体积Y2气体生成2体积气体化合物,则该化合物的化学式为( )
| A、XY |
| B、XY3 |
| C、X3Y |
| D、X2Y3 |
下列物质:①盐酸 ②食盐水 ③熔化的氯化钠 ④液态氯化氢 ⑤铜 ⑥氨水 ⑦SO3 ⑧醋酸,其中可以导电并且属于强电解质的是( )
| A、只有③ | B、①②③⑥⑧ |
| C、④⑤ | D、全部都是 |
在一定温度下的定容密闭容器中,当下列物理量不再变化时,表明反应:A(s)+2B(g)?C(g)+D(g)已达平衡的标志是( )
| A、混合气体的压强 |
| B、混合气体的密度 |
| C、容器内B、C、D的浓度之比为2:1:1 |
| D、混合气体的总物质的量 |
下列离子方程式正确的是( )
| A、碳酸氢钠溶液与少量石灰水反应:HCO3-+Ca2++OH-=CaCO3↓+H2O |
| B、氯气溶于水:Cl2+H2O?2H++Cl-+ClO- |
| C、亚硫酸氢钠溶液中滴加硫酸氢钠溶液:H++HSO3-=SO2↑+H2O |
| D、氢氧化铁溶于氢碘酸溶液:Fe(OH)3+3H+=Fe3++3H2O |
100mL 6mol?L-1的H2SO4跟过量的锌反应,在一定温度下,为减缓反应速率,但又不影响生成氢气的总量,可向反应物中加入少量的( )
| A、硫酸钠固体 |
| B、醋酸钠固体 |
| C、硫酸铜溶液 |
| D、硝酸钾溶液 |