题目内容
下列离子方程式正确的是( )
| A、碳酸氢钠溶液与少量石灰水反应:HCO3-+Ca2++OH-=CaCO3↓+H2O |
| B、氯气溶于水:Cl2+H2O?2H++Cl-+ClO- |
| C、亚硫酸氢钠溶液中滴加硫酸氢钠溶液:H++HSO3-=SO2↑+H2O |
| D、氢氧化铁溶于氢碘酸溶液:Fe(OH)3+3H+=Fe3++3H2O |
考点:离子方程式的书写
专题:离子反应专题
分析:A.少量石灰水完全反应,生成碳酸钙、碳酸钠和水;
B.HClO在离子反应中保留化学式;
C.反应生成硫酸钠、水、二氧化硫;
D.发生氧化还原反应生成碘化亚铁、碘、水.
B.HClO在离子反应中保留化学式;
C.反应生成硫酸钠、水、二氧化硫;
D.发生氧化还原反应生成碘化亚铁、碘、水.
解答:
解:A.碳酸氢钠溶液与少量石灰水反应的离子反应为2HCO3-+Ca2++2OH-=CO32-+CaCO3↓+2H2O,故A错误;
B.氯气溶于水的离子反应为Cl2+H2O?H++Cl-+HClO,故B错误;
C.亚硫酸氢钠溶液中滴加硫酸氢钠溶液的离子反应为H++HSO3-=SO2↑+H2O,故C正确;
D.氢氧化铁溶于氢碘酸溶液的离子反应为2I-+2Fe(OH)3+6H+=2Fe2++6H2O+I2,故D错误;
故选C.
B.氯气溶于水的离子反应为Cl2+H2O?H++Cl-+HClO,故B错误;
C.亚硫酸氢钠溶液中滴加硫酸氢钠溶液的离子反应为H++HSO3-=SO2↑+H2O,故C正确;
D.氢氧化铁溶于氢碘酸溶液的离子反应为2I-+2Fe(OH)3+6H+=2Fe2++6H2O+I2,故D错误;
故选C.
点评:本题考查离子反应方程式书写的正误判断,为高频考点,把握发生的反应及离子反应的书写方法为解答的关键,侧重氧化还原反应及量有关的离子反应考查,题目难度不大.

练习册系列答案
相关题目
据已有知识和元素性质递变规律来判断下列比较正确的是( )
| A、第二周期氢化物易燃性:CH4<NH3<H2O( ) |
| B、第三周期氢化物稳定性:SiH4>PH3>H2S>HCl |
| C、化合物毒性:若PH3>NH3,则H2S>H2O |
| D、氢化物的还原性:HF>H2O>NH3>CH4 |
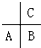 短周期元素A、B、C(均不为稀有气体元素)在周期表中的位置如图:下列说法正确的是( )
短周期元素A、B、C(均不为稀有气体元素)在周期表中的位置如图:下列说法正确的是( )| A、若均为非金属元素,其气态氢化物稳定性:A<B<C |
| B、若均为金属元素,其最高价氧化物的水化物的碱性:A<B<C |
| C、原子半径:A>C>B |
| D、最高正价:A>B>C |
2007年10月24日,我国自行研发的第一颗探月卫星“嫦娥一号”顺利升空.“嫦娥一号”的主要任务之一是探明月球上
He量.据科学家预测,月球的土壤中吸附着数百万吨的
He,每百吨
He核聚变所释放出的能量相当于目前人类一年消耗的能量.下列关于
He的说法中,不正确的是( )
| 3 |
| 2 |
| 3 |
| 2 |
| 3 |
| 2 |
| 3 |
| 2 |
| A、中子数为1 |
| B、质子数为2 |
| C、质量数为3 |
D、原子结构示意图是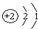 |
除去粗盐中的Ca2+、Mg2+、SO42-,可将粗盐溶于水后进行如下操作:①过滤,②加过量的NaOH溶液,③加适量的盐酸,④加过量的Na2CO3溶液,⑤加过量的BaCl2溶液,⑥蒸发结晶,其中操作顺序正确的是( )
| A、①②③④⑤⑥ |
| B、②⑤④①③⑥ |
| C、①②④⑤③⑥ |
| D、④②③①⑤⑥ |
 如图是某学校实验室从化学试剂商店买回的浓硫酸试剂标签上的部分内容.现用该浓硫酸配制200mL 1.0mol/L的稀硫酸.可供选用的仪器有:
如图是某学校实验室从化学试剂商店买回的浓硫酸试剂标签上的部分内容.现用该浓硫酸配制200mL 1.0mol/L的稀硫酸.可供选用的仪器有: