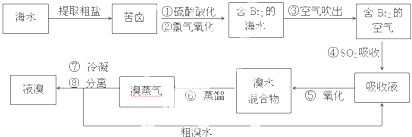
题目内容
100mL 6mol?L-1的H2SO4跟过量的锌反应,在一定温度下,为减缓反应速率,但又不影响生成氢气的总量,可向反应物中加入少量的( )
| A、硫酸钠固体 |
| B、醋酸钠固体 |
| C、硫酸铜溶液 |
| D、硝酸钾溶液 |
考点:化学反应速率的影响因素
专题:化学反应速率专题
分析:过量的锌粉反应,硫酸完全反应,为了减缓反应速率但又不影响生成氢气的总量,可减小氢离子浓度但不改变其物质的量,以此来解答.
解答:
解:A.加入硫酸钠该固体,氢离子浓度不变,反应速率不变,故A错误;
B.加入醋酸钠固体,生成醋酸,氢离子浓度减小,反应速率减小,但生成氢气的总量不变,故B正确;
C.锌置换出铜,形成原电池反应,加快反应速率,故C错误;
D.硝酸根离子在酸性条件下具有强氧化性,可与锌反应生成NO气体,故D错误.
故选B.
B.加入醋酸钠固体,生成醋酸,氢离子浓度减小,反应速率减小,但生成氢气的总量不变,故B正确;
C.锌置换出铜,形成原电池反应,加快反应速率,故C错误;
D.硝酸根离子在酸性条件下具有强氧化性,可与锌反应生成NO气体,故D错误.
故选B.
点评:本题考查影响化学反应速率的因素,为高频考点,注意信息中Zn过量及浓度对反应速率的影响即可解答,易错点为D,注意硝酸的性质,注重基础知识的考查,题目难度不大.

练习册系列答案
相关题目
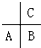 短周期元素A、B、C(均不为稀有气体元素)在周期表中的位置如图:下列说法正确的是( )
短周期元素A、B、C(均不为稀有气体元素)在周期表中的位置如图:下列说法正确的是( )| A、若均为非金属元素,其气态氢化物稳定性:A<B<C |
| B、若均为金属元素,其最高价氧化物的水化物的碱性:A<B<C |
| C、原子半径:A>C>B |
| D、最高正价:A>B>C |
除去粗盐中的Ca2+、Mg2+、SO42-,可将粗盐溶于水后进行如下操作:①过滤,②加过量的NaOH溶液,③加适量的盐酸,④加过量的Na2CO3溶液,⑤加过量的BaCl2溶液,⑥蒸发结晶,其中操作顺序正确的是( )
| A、①②③④⑤⑥ |
| B、②⑤④①③⑥ |
| C、①②④⑤③⑥ |
| D、④②③①⑤⑥ |
某有机物的结构为HO-CH2-CH=CHCH2-COOH,该有机物不可能发生的化学反应是( )
| A、水解反应 | B、酯化反应 |
| C、加成反应 | D、氧化反应 |
pH=13的 强碱与pH=2的强酸溶液混合,所得混合液的pH=7,则强碱与强酸的体积比为( )
| A、9:1 | B、1:9 |
| C、1:10 | D、10:1 |
下列叙述中正确的是( )
| A、热化学方程式中,各物质前的化学计量数不表示分子个数 |
| B、如果反应物所具有的总能量小于生成物所具有的总能量,则发生的反应是放热反应 |
| C、在稀溶液中,1 mol酸和1 mol碱完全反应所放出的热量,叫做中和热 |
| D、在101 kPa时,1 mol物质燃烧时所放出的热量叫做该物质的燃烧热 |
下列分子中,所有原子都满足最外层为8电子结构的是( )
| A、BF3 |
| B、PCl5 |
| C、HCl |
| D、CF2Cl2 |